Complexe QRS secondaire à un influx d’origine ventriculaire (arythmie ventriculaire).
- Extrasystoles ventriculaires
- Rythme d’échappement ventriculaire
- RIVA
- Tachycardie ventriculaire ou torsade de pointes
Critères morphologiques en faveur d’une ectopie
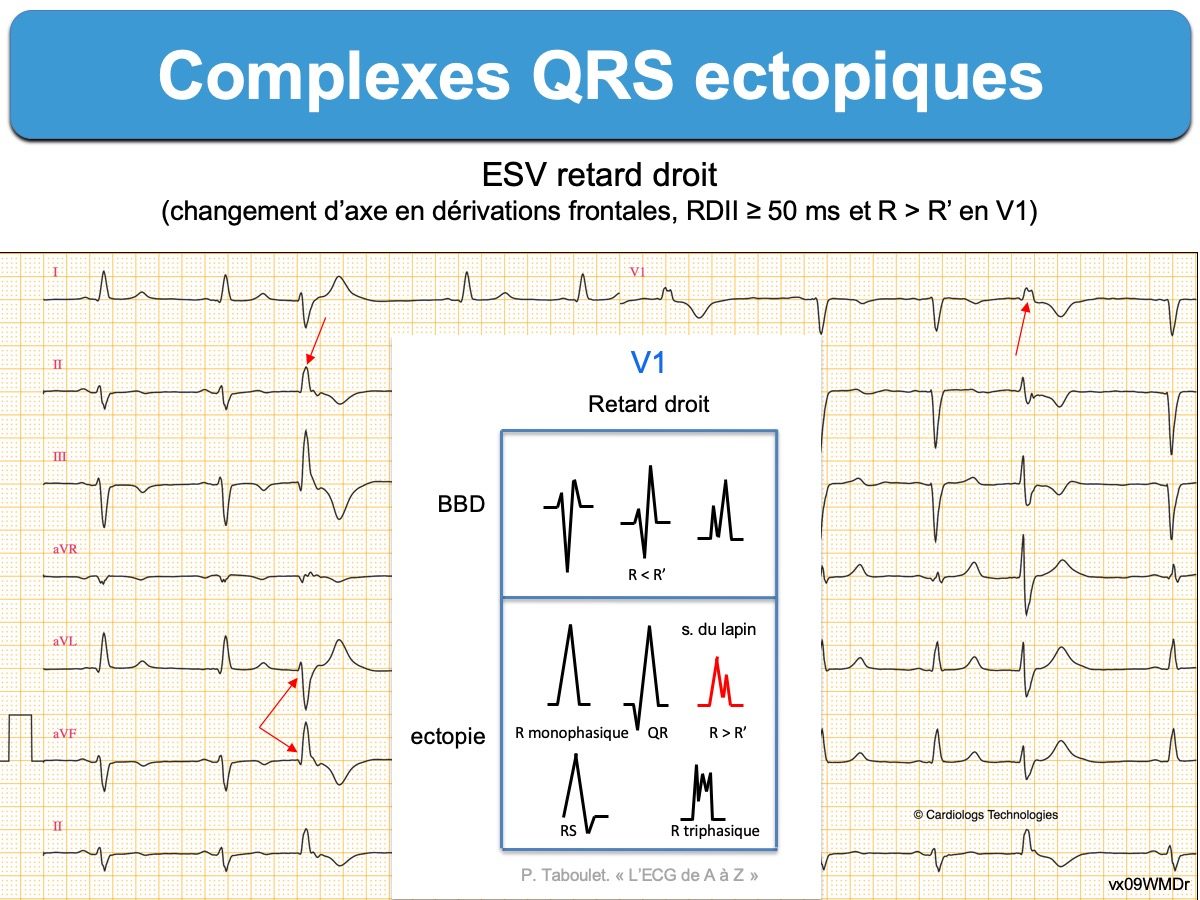
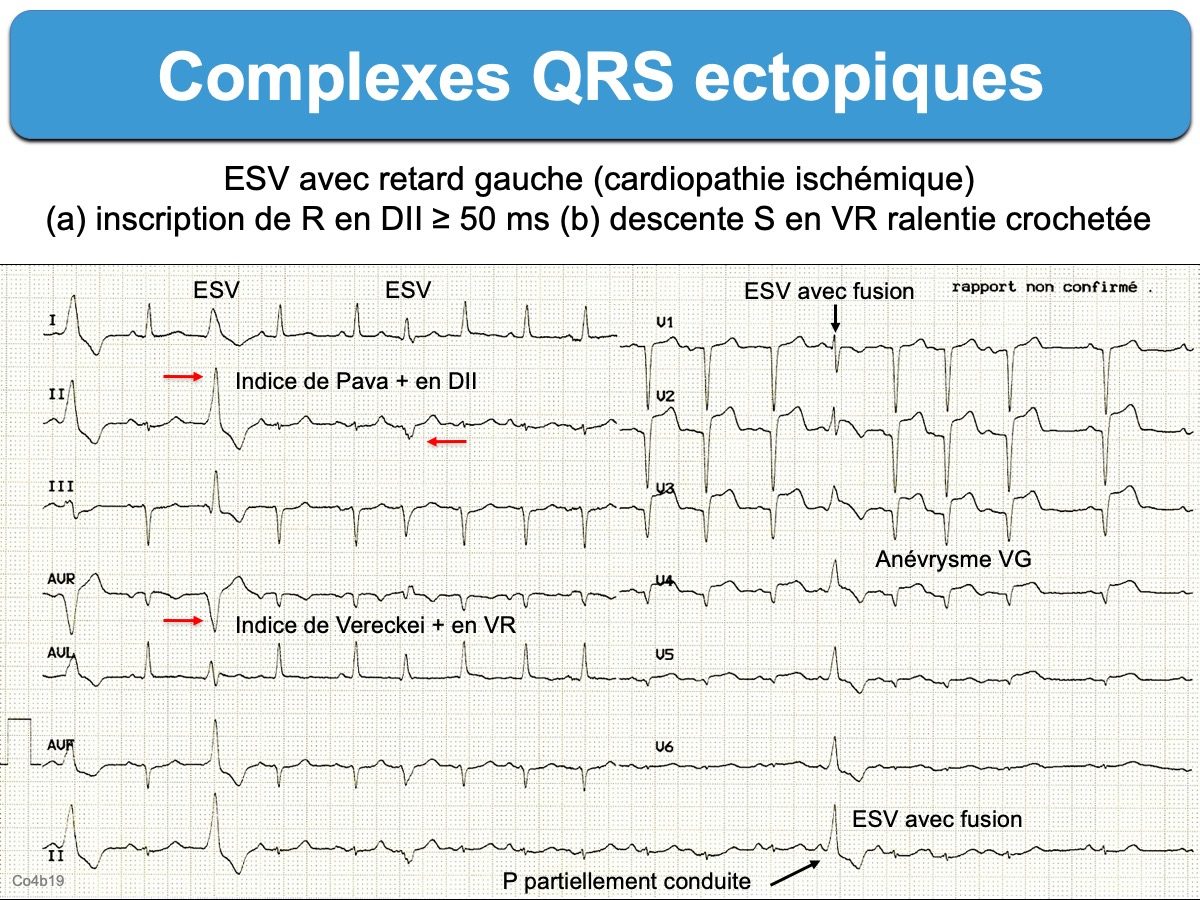
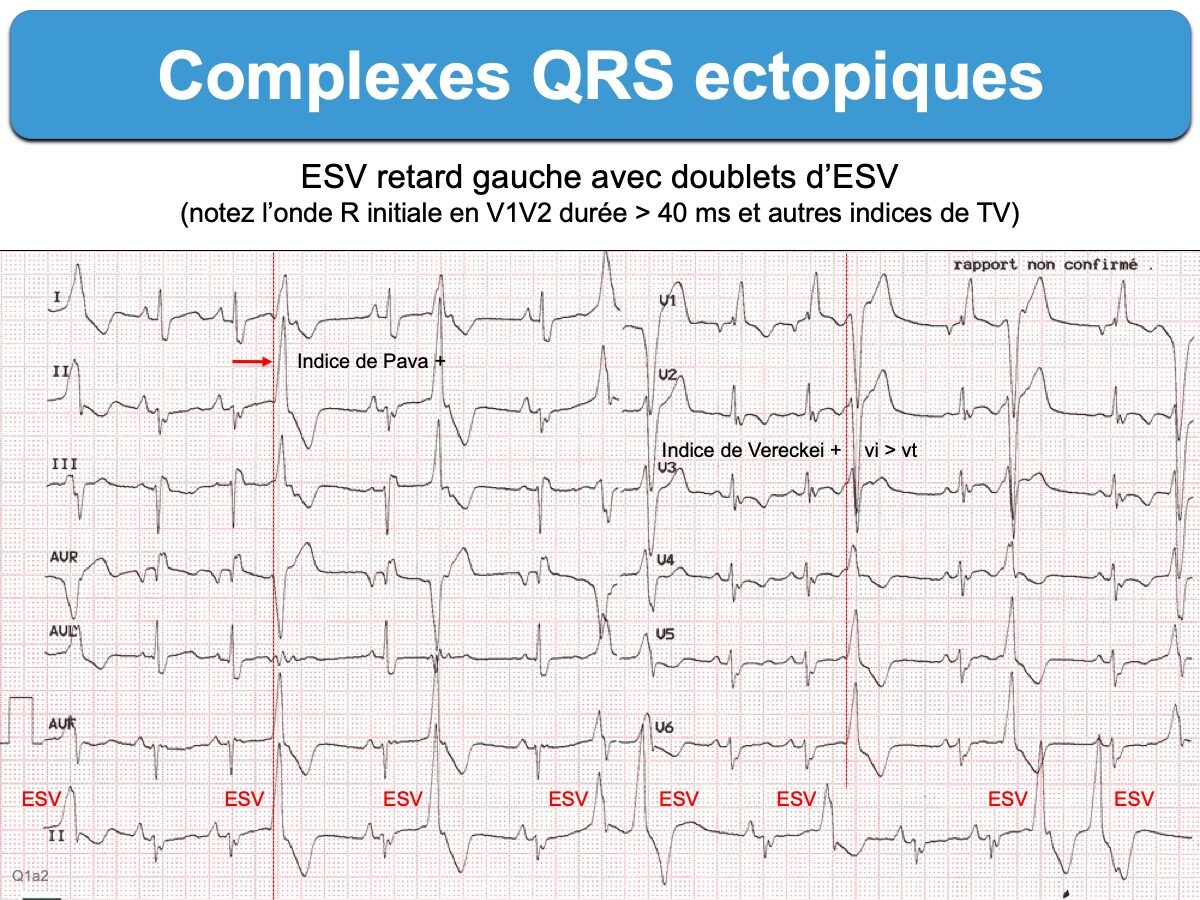
Les complexes QRS ectopiques n’ont en général pas les caractéristiques morphologiques d’un bloc de branche ou d’un bloc bifasciculaire (cf. Complexes QRS aberrants) car une ESV est initiée dans le myocarde ventriculaire, plus ou moins loin des voies rapides de conduction intraventriculaire. Leur déflexion initiale est souvent élargie et déformée par rapport aux QRS fins du patient. De nombreux indices morphologiques permettent de distinguer (cf. Indices de TV).
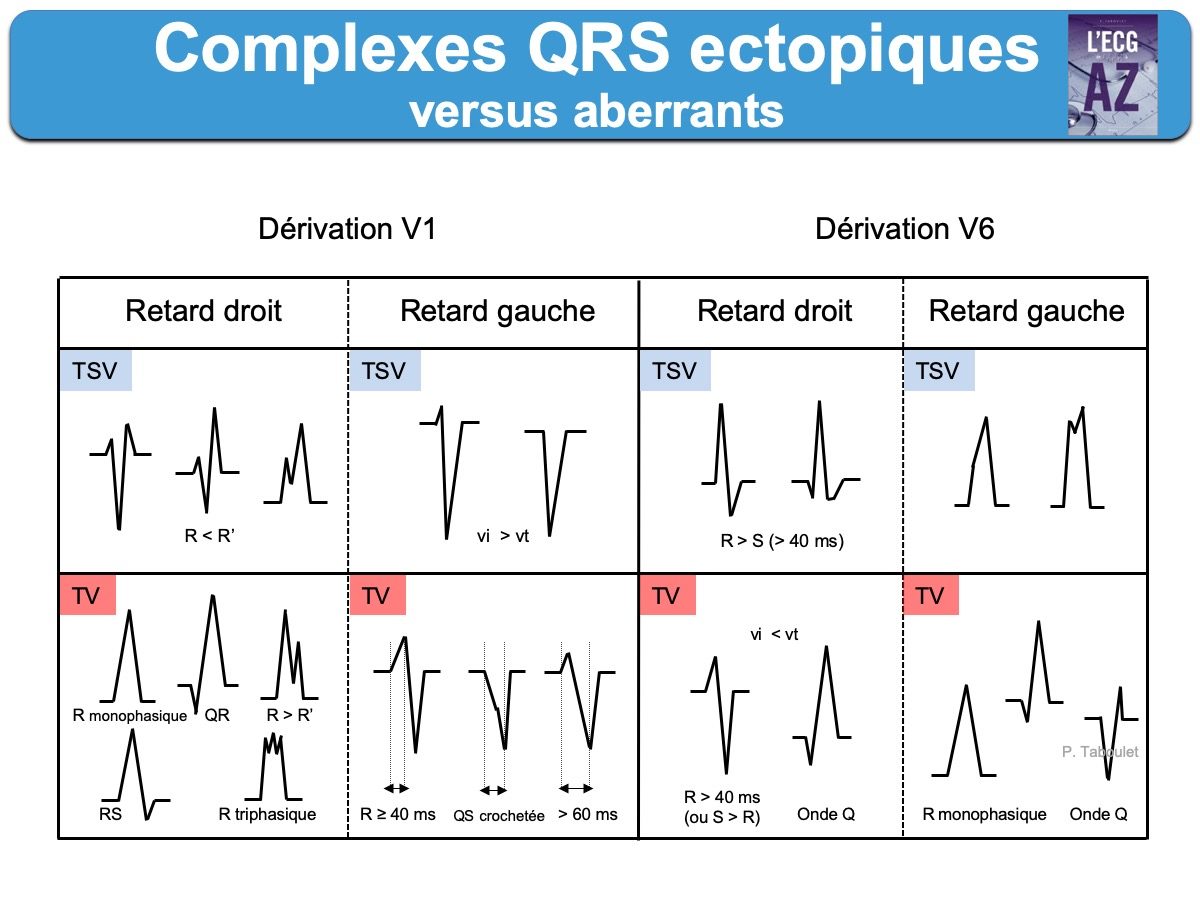
Les critères morphologiques ne suffisent pas toujours en cas de tachycardie irrégulière avec des QRS larges pour distinguer un complexe QRS aberrant d’un complexe QRS ectopique, surtout en cas de tachycardie à QRS larges. Il faut alors s’aider des règles de l’aberration et de celles de l’ectopie.
Règles en faveur en faveur d’une ectopie ventriculaire [1][2][3]
- Une onde P avant le(s) QRS large(s) est absente ou trop précoce pour être conduite (mais un complexe de fusion est possible)
- Le couplage entre le QRS précédant et le(s) QRS large(s) est très court (prématurité indue)
- Une pause ventriculaire est visible après le(s) QRS large(s) (réinitialisation ou inhibition)*
- La morphologie de(s) QRS larges(s) est compatible avec une ectopie ventriculaire (voir ci-dessus)*.
- Le(s) QRS large(s) est/sont similaire(s) à une ectopie connue.
Certains critères peuvent manquer : certaines ESV interpolées ne décalent pas l’onde P sinusale ou le complexe P-QRS consécutif (cf. Conduction cachée) ; certaines ESV ont un couplage très court (cf. ESV maligne) ; certaines ESV ont un aspect de bloc de branche ou de bloc bifasciculaire, car l’influx ectopique est issu ou proche du faisceau de His (cf. TV de branche à branche, TV fasciculaire, TV septale).
Lire : Complexes QRS aberrants/ectopiques
Pour compléter vos connaissances
20 Quiz (niveau 1-2) : aberration ou ectopie ?