Généralités sur l’infarctus non ST+
L’infarctus non ST+ est plus fréquent que l’infarctus ST+ et la population touchée est en moyenne plus âgée [1]. Les présentations cliniques et ECG sont très variables et traduisent des syndromes différents avec des pronostics différents [2], selon la présence ou non d’une occlusion coronaire aiguë et d’une prise en charge optimale [3][4][5]. Le diagnostic d’occlusion coronaire aiguë est souvent fait avec retard ce qui peut engager le pronostic vital ou entrainer des séquelles fonctionnelles.
Il faut y penser devant tout symptôme compatible avec un syndrome coronaire aigu comme une douleur thoracique ou équivalent, une syncope, une dyspnée inexpliquée, une mort subite récupérée… (cf. Syndrome coronaire aigu).
L’ECG doit être réalisé le plus précocement possible en cas de suspicion de SCA. Par définition d’un SCA non ST+ (ESC 2023 [9]), il ne révèle pas d’élévation nouvelle et persistante du segment ST+ ≥ 1 mm dans deux dérivations contiguës (ou ≥ 1,5-2,5 mm en V2-V3 selon le sexe et l’âge, cf. Sus-décalage de ST). Il révèle des anomalies comme un sous-décalage de ST, un sus-décalage de ST subtil ou non persistant, des anomalies de l’onde T et/ou des ondes Q de nécrose ou encore un bloc de branche atypique. Des anomalies du rythme sont possibles (cf. Infarctus et rythme). Il est souvent dynamique et peut évoluer favorablement spontanément sous traitement ou – au contraire – défavorablement. L’ECG est parfois peu contributif au diagnostic et peut même égarer le clinicien (aspect normal ou subnormal).
La biologie doit être réalisée précocement après l’ECG. Le diagnostic d’infarctus nécessite une cinétique positive (ou négative) de troponine, mais des formes ECG caractéristiques d’occlusion coronaire aiguë non-ST+ permettent parfois de shunter cette étape (avec l’aide notamment de l’intelligence artificielle, ex. PmCardio®) (Byrne ESC 2023 [9] et Smith et Frick 2025 [18]). Les patients qui présentent une occlusion coronaire aiguë ont des valeurs de troponine élevées (pic > 1000 ng/l) comparables aux valeurs observées en cas de sus-décalage de ST [32]. L’angor stable ou instable ne s’accompagne pas d’élévation de la troponine.
L’angiographie coronaire a pour but de rechercher une occlusion coronaire aiguë et des lésions coronaires rapidement curables par angioplastie ou plus rarement par pontage aorto-coronarien. Elle est souvent différée en cas de résolution complète des symptômes, ou retardée par la difficulté du diagnostic et la méconnaissance des formes sévères. Les artères occluses coupables sont plus souvent la coronaire droite ou la circonflexe que l’interventriculaire antérieure, mais des lésions coronaires multiples ou une occlusion du tronc commun de la gauche sont fréquentes [3][14]. En cas d’occlusion coronaire aiguë, le pronostic à court terme est alors sévère, proche de celui des infarctus ST+ [3][4]. C’est pourquoi l’identification précoce des présentations ECG évoquant une occlusion coronaire aiguë (« équivalent ST+ ») est essentielle afin d’envisager au plus vite une revascularisation précoce et réduire le risque de séquelle fonctionnelle ou le pronostic vital [5][7][8] [18].
L’échocardiographie peut également participer à la reconnaissance précoce d’une occlusion coronaire aiguë ou un diagnostic différentiel comme une embolie pulmonaire sévère, une péricardite aiguë, voire une dissection aortique ou un pneumothorax.
Le sous-décalage de ST
Le sous-décalage de ST est l’anomalie la plus fréquente rencontrée chez les patients qui présentent des symptômes d’ischémie coronaire au repos et un ECG initial anormal [2]. La valeur seuil qui doit faire évoquer un infarctus non ST+ en situation clinique compatible avec une ischémie myocardique aiguë ou un infarctus a été définie par l’ESC en 2023 [9]) :
Un nouveau sous-décalage de ST ≥ 0,5 mm (0,05 mV) au niveau du point J dans au moins 2 dérivations contiguës. Il est généralement horizontal (raide). L’onde R est respectée, parfois proéminente ou avec un ratio R/S > 1.
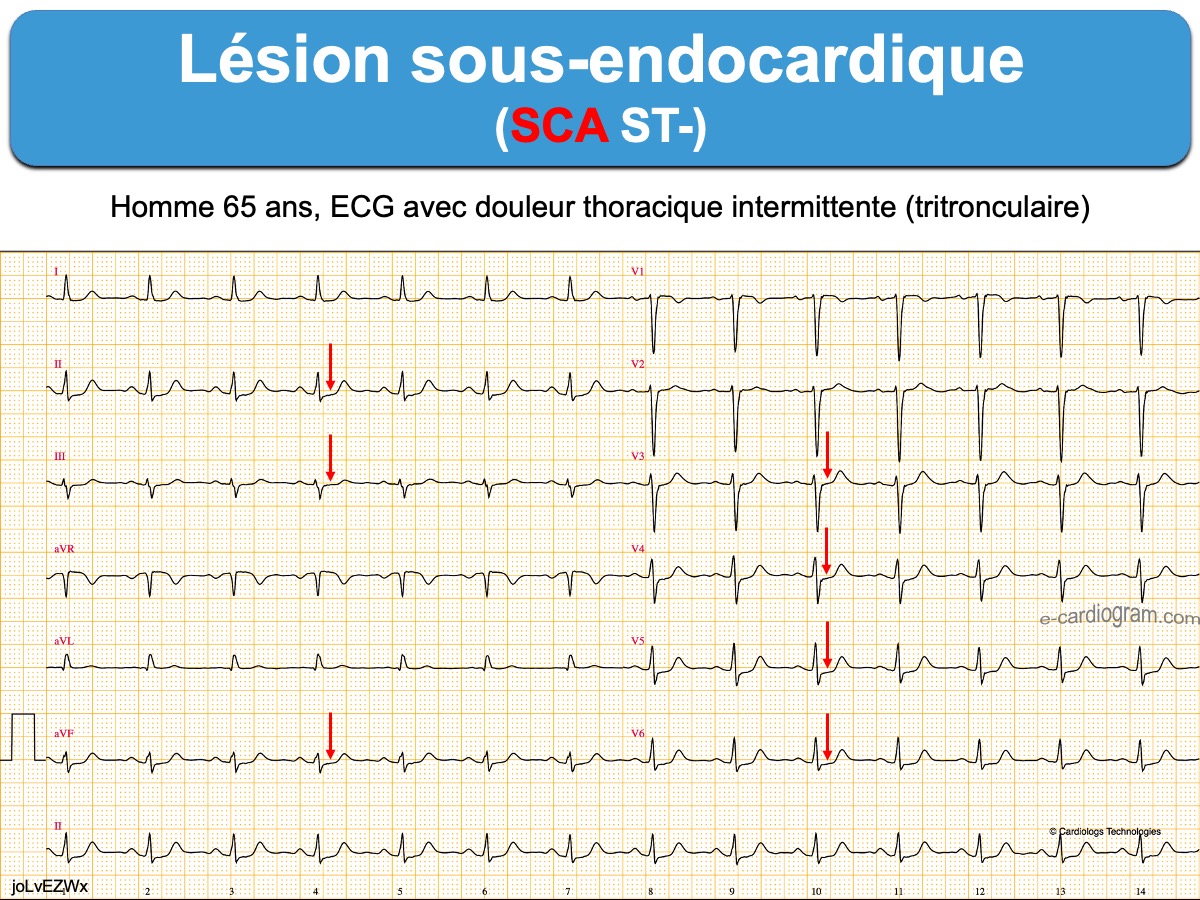
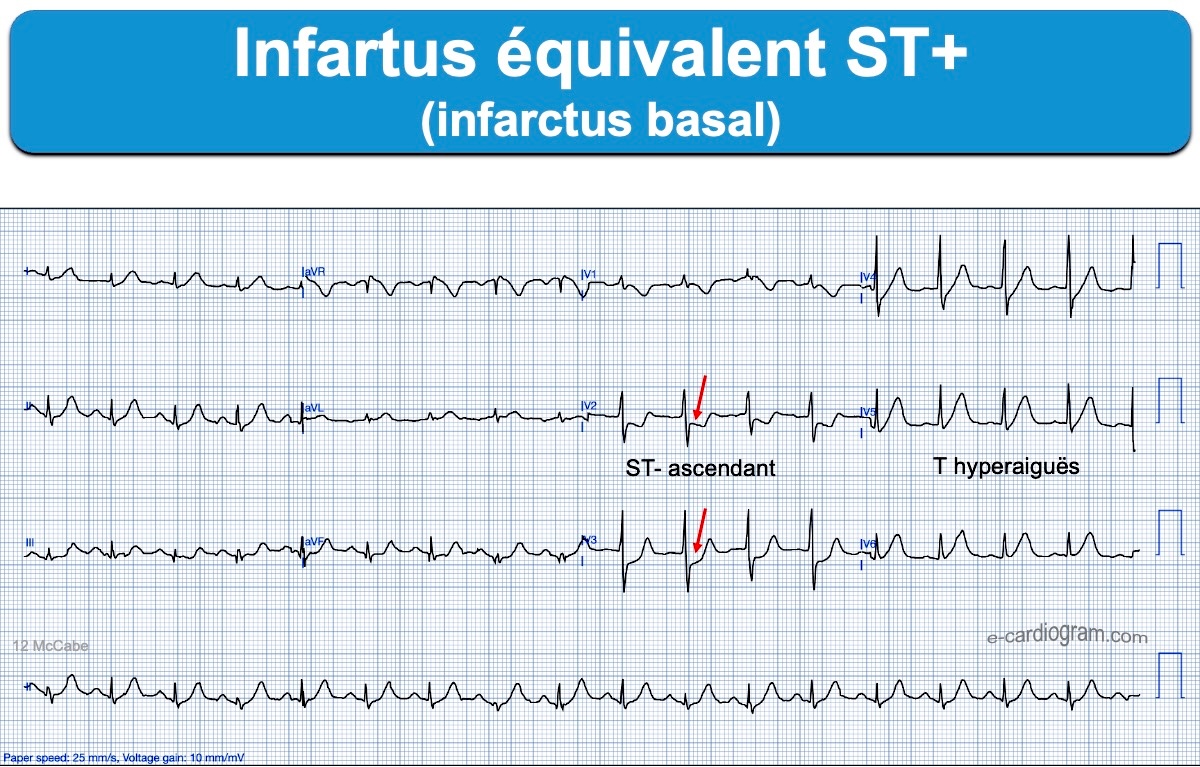
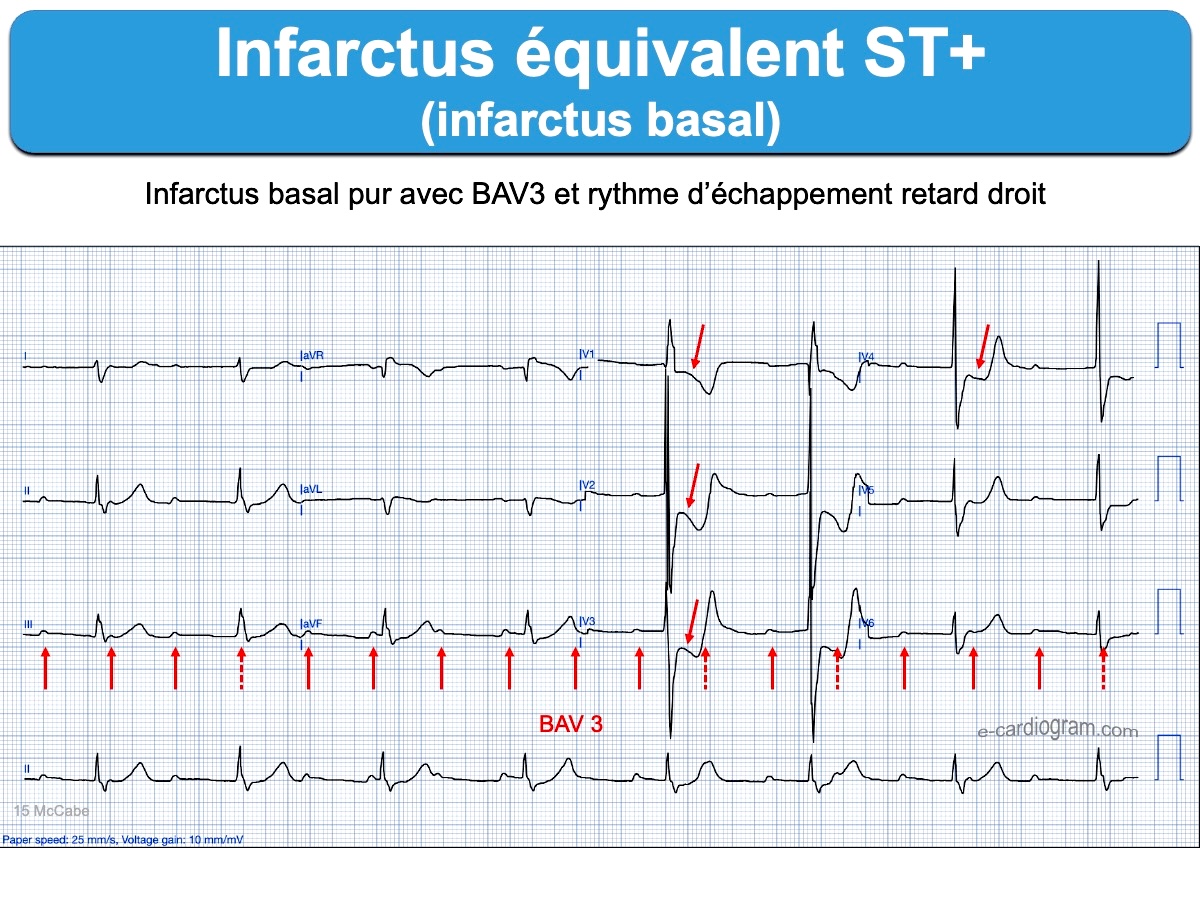
Plus le segment ST est sous-décalé, plus grand est le risque d’occlusion coronaire aiguë [2]. La mesure précise de l’amplitude du sous-décalage de ST est délicate et doit être interprétée en fonction de l’amplitude du QRS qui le précède (règle de la proportionnalité) car le décalage de ST est minoré par des QRS microvoltés et majoré par des QRS amples et rapides. Tout sous-décalage de ST, même minime, en V1-V4 doit faire évoquer une occlusion coronaire aiguë dans le territoire basal/postérieur. L’enregistrement des dérivations V7-V9 est alors recommandé (cf. Infarctus basal).
- Si l’aspect horizontal ou descendant (ST raide) est évocateur d’une ischémie myocardique, il est souvent difficile à distinguer du sous-décalage de ST évocateur d’une surcharge ventriculaire ou « strain pattern » (cf. Hypertrophie ventriculaire).
- En cas de reperfusion coronaire, spontanée ou provoquée, on peut observer une combinaison de lésion sous-épicardique (ST+) et ischémie sous-épicardique (T-) très évocatrice appelée « ischémie-lésion » ou encore une ischémie sous-épicardique (« ondes T de reperfusion ») appelées parfois « ondes T de Wellens » (cf. Syndrome de Wellens).
Les seuils académiques pour un ST- (Ibanez ESC 2017 [10]) manquent de spécificité et peuvent traduire :
- a) une ischémie myocardique avec coronaropathie et infarctus aigu (avec ou sans occlusion coronaire) ou sans infarctus aigu (maladie coronaire stable ou séquelles d’infarctus) ; b) une ischémie myocardique sans coronaropathie, avec ou sans infarctus biologique (ischémie fonctionnelle, tako-tsubo…),
- c) de très nombreux diagnostics différentiels de l’ischémie aiguë (cf. Sous-décalage de ST)
NB. Les termes lésion sous-endocardique ou sous-épicardique sont descriptifs, mais ne traduisent pas exactement les phénomènes locaux. Idem pour ischémie sous-endocardique ou sous-épicardique.
Anomalies de l’onde T
Les seuils académiques définis en 2018 qui doivent faire évoquer un infarctus non ST+ en situation clinique compatible avec une ischémie myocardique aiguë ou un infarctus sont une onde T inversée ≥ 1 mm (0,1 mV) ou diphasique (+/-) dans au moins 2 dérivations contiguës avec une onde R proéminente ou un ratio R/S > 1 (ESC 2018 [9]).
1. Les ondes T inversées
- Une onde T inversée dans le contexte d’un SCA (sans onde T géante en miroir) est un signe que l’ischémie est résolutive, en particulier si le tracé est dynamique (changeant). Elle est typiquement ≥ 3 mm [19]), symétrique et large avec parfois prolongation de l’intervalle Q-T [20]. Si l’onde T est inversée profonde (« giant negative T waves »), une reperfusion/désocclusion coronaire récente est hautement probable [21]. Si l’onde T a été précédée de quelques heures par une onde T diphasique (T+/- avec « terminal T-wave inversion”), il faut évoquer un syndrome de Wellens [22]. Une prise en charge médicale rapide est recommandée, car une réocclusion complète est à redouter à court terme [23]. L’onde T inversée ischémique profonde peut régresser en quelques heures/jour ou se repositiver brutalement en cas de réocclusion (« pseudonormalisation »). Elle peut persister plusieurs mois en cas d’infarctus (cf. Séquelle d’infarctus).
- Une onde T inversée de faible amplitude (≥ 1 mm) dans deux dérivations où l’onde R est proéminente (R/S > 1) peut aussi traduire isolément une ischémie coronaire subaiguë, en particulier en territoire inférieur ou latéral [24]. Elles peuvent correspondre à un miroir d’onde T+ ischémique en territoire opposé. En règle générale, les anomalies mineures de l’onde T doivent alerter le clinicien, mais elles manquent de spécificité et se rencontrent dans de nombreuses situations. Elles peuvent s’observer physiologiquement chez l’adulte jeune en dérivations V1-V3 (cf. Persistance de la repolarisation juvénile) [25], à tout âge dans le territoire latéral haut (VL) ou inférieur (DIII-VF), chez l’Africain (cf. Inversion bénigne de l’onde T) ou chez les sujets âgés dans les dérivations latérales (V5-V6 et DI-VL) en rapport avec des vitesses de repolarisation différentes entre endocarde et épicarde, physiologiques ou liées à l’âge [26].
- Des ondes T inversées ne sont pas spécifiques d’une lésion coronaire aiguë et s’observent dans d’autres situations aiguës (notamment la cardiomyopathie de stress appelée parfois takotsubo, une embolie pulmonaire ou une souffrance cérébrale aiguë. Elles peuvent s’observer en lien avec une pathologie coronaire chronique (cf. Séquelle de nécrose) ou au cours de l’évolution de certaines pathologies (cf. Sous-décalage de ST) [27].
2. Les ondes T amples hyperaiguës
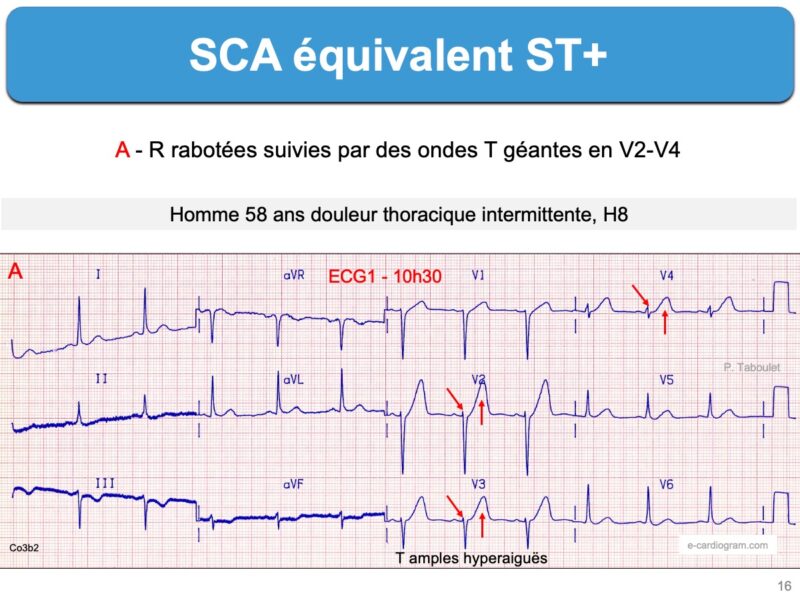
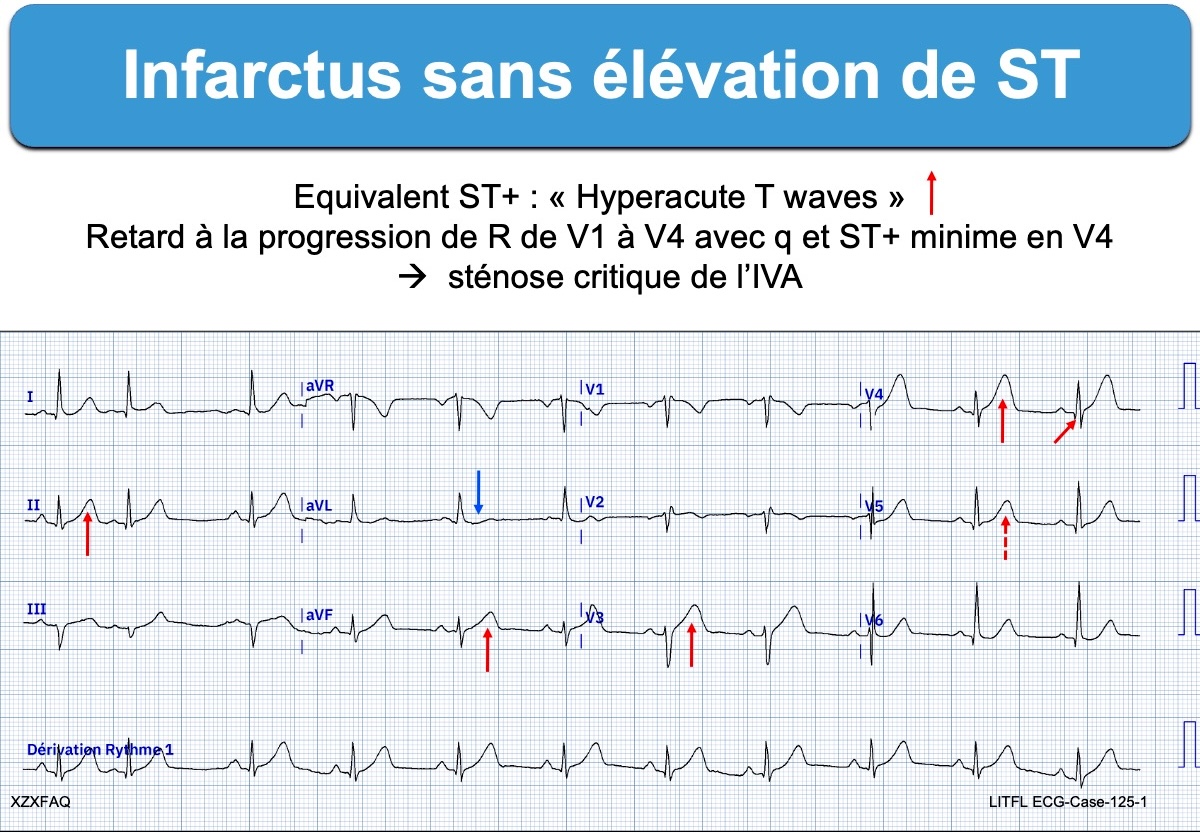
Les ondes T amples et symétriques (hyperaiguës au sens de l’angle aigu) sont considérées comme des « équivalents ST+« . Elles débutent rapidement après la fin du QRS et présentent une ascension rapide. Elles ont une base large caractéristique. Elles rattrapent ou dépassent l’onde R dans deux dérivations contiguës. Elles sont dynamiques (modifications rapides) et peuvent évaluer dans un sens (aggravation et ST+) ou dans un autre (reperfusion). Une alternance électrique de T d’un battement à l’autre est un signe de gravité (cf. Alternance électrique de T).
Pour tester vos connaissances: 20 Quiz (niveau 1-2) : Coronaropathie ?
Ondes Q de nécrose
- Des ondes Q de nécrose peuvent s’inscrire à tous les stades d’un infarctus non ST+, mais sont généralement présentes sur l’ECG initial. Elles sont souvent associées à des QRS peu voltés, un minime ST+ [12] ou des ondes T inversées [8]. Elles peuvent manquer en cas d’infarctus non transmural ou apparaître sans corrélation avec une nécrose transmurale ventriculaire [29]. Une perte de la progression harmonieuse de l’onde R de V1 à V3-V4 (ex. onde r de 1-2 mm en V4, dans le cadre d’une pathologie ischémique) ou des complexes QRS fragmentés dans deux dérivations contiguës, est considérée parfois comme un équivalent d’onde Q de nécrose [30].
ECG normal
Un ECG normal ou subnormal chez un patient qui n’a plus mal (a fortiori s’il a encore mal) n’exclut pas la possibilité d’un SCA (a fortiori si les biomarqueurs cardiaques sont discrètement positifs). En effet, une occlusion/sub-occlusion coronaire aiguë avec une repolarisation normale ou subnormale sur l’ECG est possible (environ 5% des cas d’infarctus) en cas de petit territoire coronaire ischémique, en particulier si l’ischémie est incomplète (ex. bon réseau collatéral d’aval) ou si le territoire coronaire est mal explorable (ex. Ischémie dans l’artère circonflexe) [11]. Il peut aussi s’agir d’une « pseudo-normalisation » d’un ECG de base anormal, en rapport avec l’ischémie coronaire aiguë. Il peut enfin s’agir d’une occlusion/désocclusion avec risque de ré-occlusion.
Homme 69 ans. Douleur dorsale tenace depuis 24h. Troponine 10.000 ! Occlusion circonflexe et sténose IVA 70%

Pour toutes ces raisons, si la situation clinique est évocatrice d’ischémie coronaire (douleur évocatrice, sujet à risque, pas de diagnostic alternatif clair), il est difficile d’écarter le diagnostic de syndrome coronaire aigu ou d’infarctus devant un ECG initial normal, atypique ou peu modifié – surtout en cas de bloc de branche ou hypertrophie ventriculaire – sans multiplier les tracés ni s’aider de la biologie et/ou de l’imagerie (cf. ECG en situation ischémique).
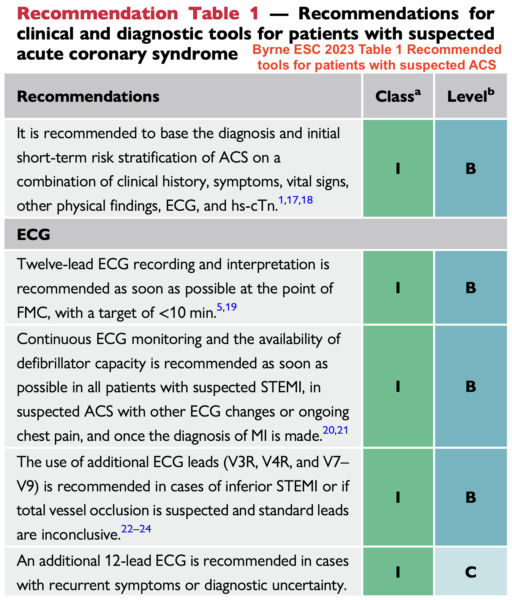
Si l’ECG est « non concluant » et la suspicion d’occlusion coronaire forte, il est recommandé d’enregistrer les dérivations V8-V9 et V3R-V4R [9], mais le niveau de preuve est faible (et je ne connais pas de cas clinique validant cette stratégie).
Si l’ECG reste normal ou non concluant, mais que les symptômes sont évocateurs et persistants malgré le traitement médical, il faut adresser les patients suspects d’occlusion coronaire aiguë pour une angiographie coronaire à réaliser dans les 2 heures (ESC 2023 [9]). Évidemment, une troponine positive et l’échocardiographie au lit du patient aident considérablement le clinicien à convaincre l’angiographiste… Il faut être convaincant !!! Les patients à risque dont la douleur persiste (éviter la morphine quand on ne comprend pas) doivent être adressés pour une angiographie coronaire à visée diagnostique dans les 120 minutes ! Si vous n’êtes pas convaincus, lisez le blog de SW Smith (Minneapolis, Minnesota) ou du moins ce cas clinique janvier 2024 (Three normal high sensitivity troponins over 4 hours with a « normal ECG »).
Si l’ECG reste normal et les biomarqueurs cardiaques négatifs ou non évolutifs, on peut exclure un SCA, mais pas complètement une ischémie coronaire stable [31]. D’autres examens cardiaques non invasifs sont parfois nécessaires.
Infarctus et QRS larges. Voir Infarctus et BBG, Infarctus et BBD ou Infarctus et pacemaker
Référence indispensable : Miranda DF, Lobo AS, Walsh B, Sandoval Y, Smith SW. New Insights Into the Use of the 12-Lead Electrocardiogram for Diagnosing Acute Myocardial Infarction in the Emergency Department. Can J Cardiol [Internet] 2018;34(2):132–45.
Occlusion coronaire aiguë non ST+
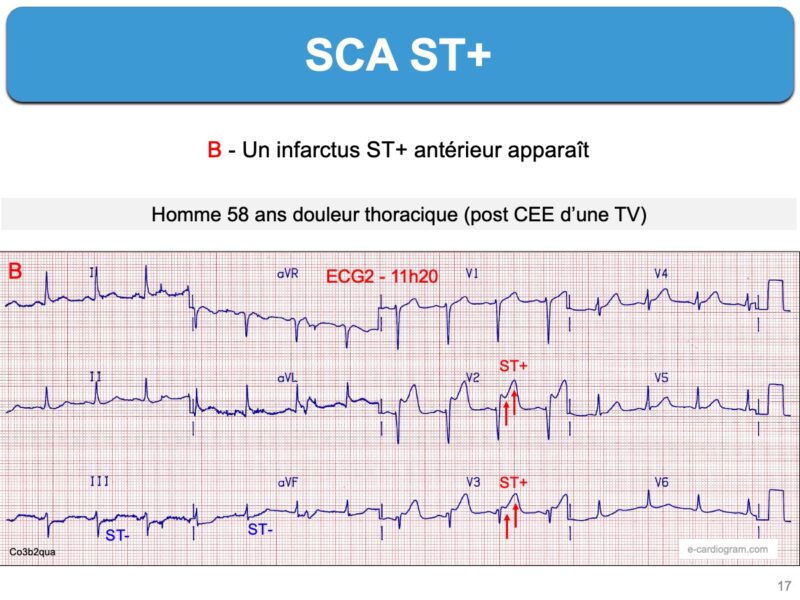
Une occlusion coronaire aiguë (« Occlusion myocardial infarction » ou OMI) ne s’accompagne pas de sus-décalage de ST, au seuil défini par l’ESC en 2023, dans presque 30% des cas [3][5][9]. L’occlusion coronaire aiguë non ST+ (non STEMI OMI pour S. Smith ou nonacademic STEMI) a un mauvais pronostic en raison du retard diagnostique et thérapeutique des formes sévères (douleur persistante ≥ 2 heures, arythmie ventriculaire, troubles hémodynamiques…). Cette entité est mal enseignée et une source de conflits entre médecins spécialistes lorsqu’elle n’est pas reconnue comme synonyme d’une (pré)occlusion coronaire.
L’existence d’un « SCA non ST+. équivalent ST+ », en situation clinique compatible avec une ischémie myocardique évolutive, est une entité admise par l’AHA en 2022 [8] et l’ESC en 2023 [9] sous l’impulsion du Pr Steve Smith (Minnesota, le pape de l’ECG dans le domaine du SCA/infarctus) [5].
Une mise point a été publiée en 2025 par Smith et ses collaborateurs pour la reconnaissance des signes d’occlusion coronaire non ST+ (visio conférence [12]) et narratif review 2025 [6]).
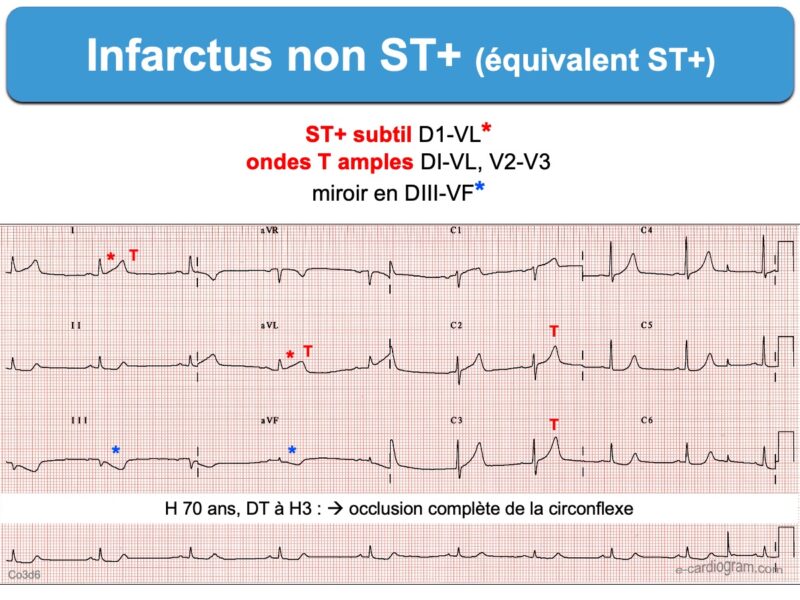
- des ondes T amples ou « hyperacute T-waves » (cf. Ondes T amples ischémiques) : elles sont à base large et de surface exagérée par rapport à l’amplitude des QRS [5]. Elles sont dynamiques et peuvent régresser ou évoluer vers un infarctus ST+ typique (cf. ci-dessous).
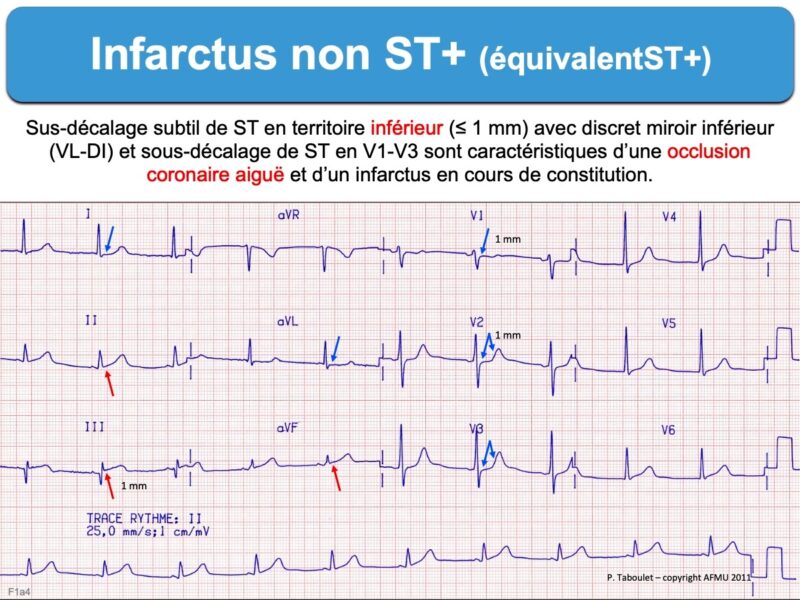
- un ST+ subtil (< 1 mm) avec présence d’ondes Q pathologiques, un ST- en miroir. Des éléments sémiologiques ECG comme le pattern d’Aslanger (occlusion CD), la distorsion terminale du QRS (occlusion IVA) et le signe du drapeau sud africain (occlusion diagonale voir infarctus latéral) peuvent renforcer l’hypothèse d’une occlusion coronaire aiguë. Là encore, il faut répéter les ECG pour apprécier l’évolutivité de l’occlusion coronaire.
- un sous-décalage de ST maximum en territoire V1-V3(V4), même minime ≤ 1 mm (cf. Infarctus basal) [14]. Ils sont souvent considérés à tort comme des infarctus non ST+, alors que l’aspect (ST- raide suivi par une onde T ample et parfois une onde R dominante dans ces dérivations) ou l’enregistrement des dérivations postérieures V8-V9 permet de reconnaitre en général facilement l’occlusion coronaire aiguë.
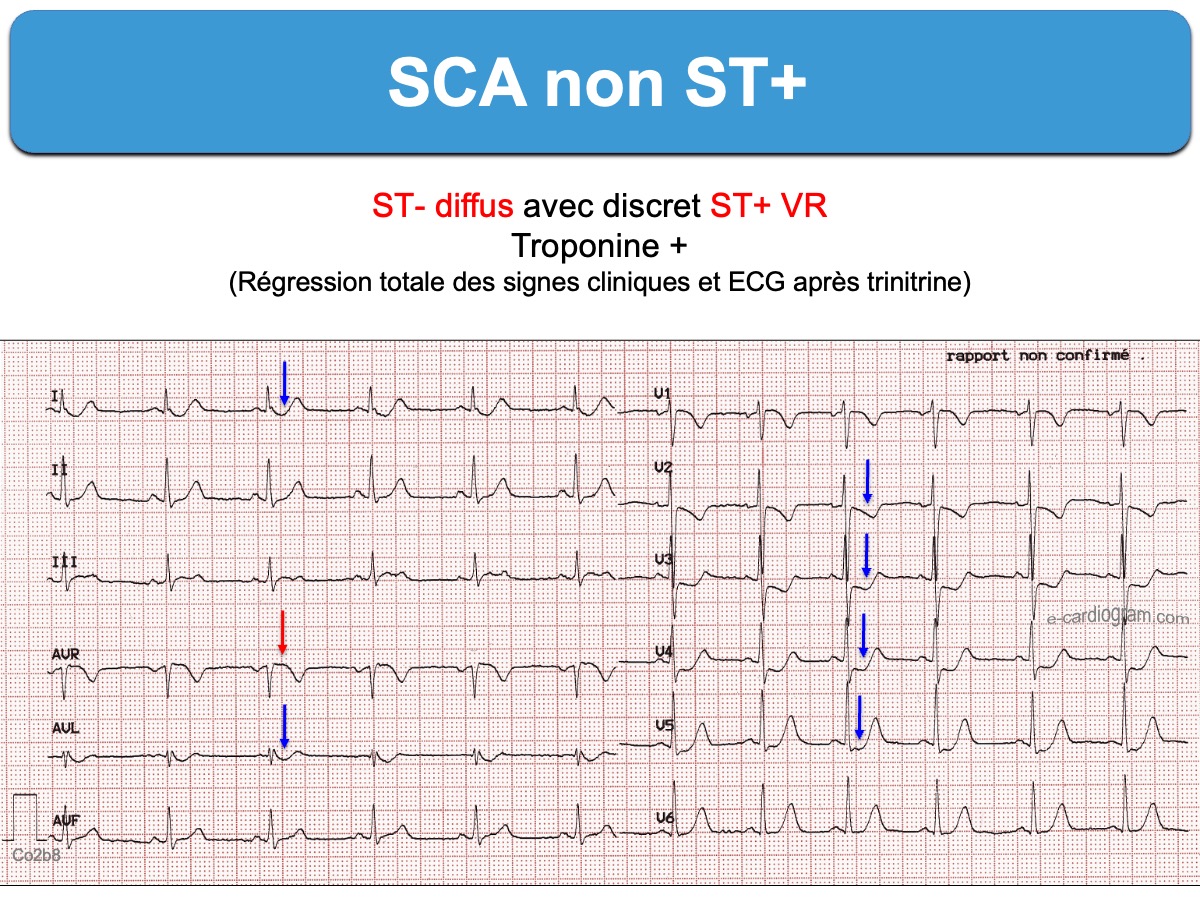
- un sous-décalage de ST diffus ≥ 1 mm avec miroir ST+ en VR(V1) qui correspond à des lésions coronaires proximales ou tritronculaires de très mauvais pronostic, en particulier si l’hémodynamique est compromise [9][18].
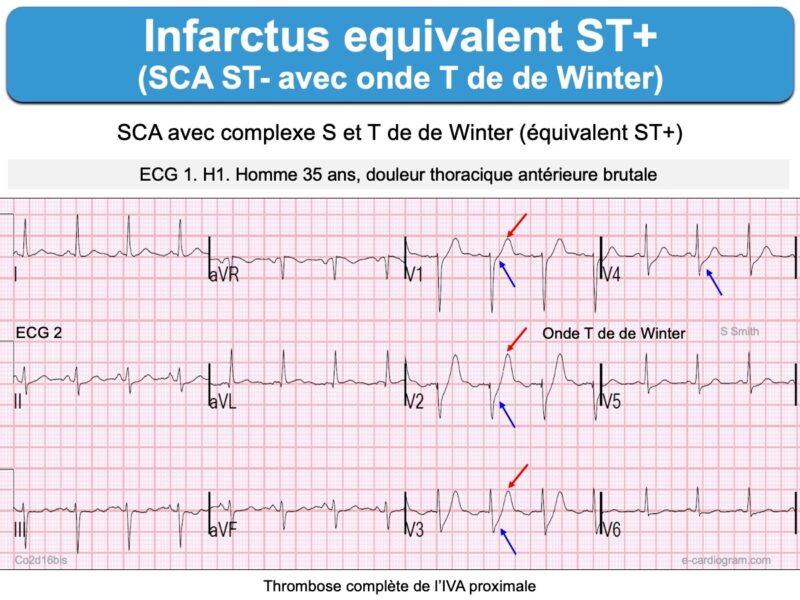
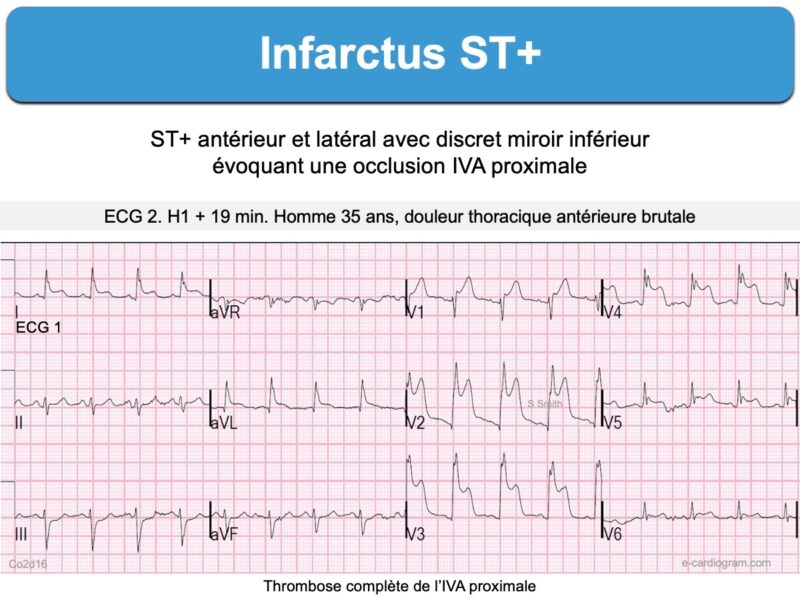
- un sous-décalage de ST ascendant à partir d’un point J sous-décalé suivi par l’ascension rapide (« take-off ») d’une onde T ample ; cette entité (Ondes T de de Winter) traduit une occlusion (quasi)complète d’une artère coronaire, en général l’IVA.
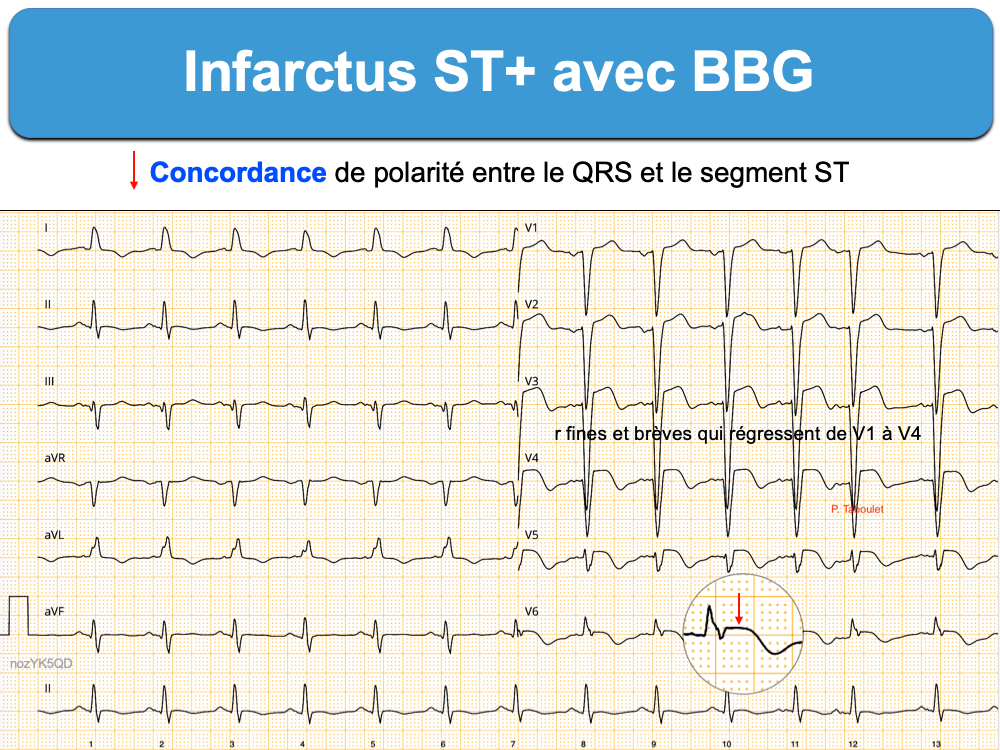
- une perte de la discordance appropriée entre la polarité des QRS et celle de la repolarisation au cours d’un bloc de branche, un QRS électroentraîné ou une préexcitation ventriculaire (cf. Infarctus avec complexes QRS larges).
Vidéo YouTube (P. Taboulet, 40 min). Les équivalents ST+ à haut risque
Conférence de Smith (nov 2023) : Diagnose Acute Coronary Occlusion Myocardial Infarction (OMI) with ECG (Powerful Medical Webinar)
Références réservées aux abonnés ou accessibles dans le livre : 100 ECG autour de l’infarctus.S- Editions 2020
La suite est réservée aux membres et stagiaires du site.
Se connecter | Devenir membre | Devenir stagiaire