Obstruction d’au moins une artère pulmonaire ou des ses branches, en général par un thrombus fibrino-cruorique (caillot). D’autres causes existent (graisse, gaz, tumeur, bactéries…).
Le diagnostic d’embolie pulmonaire (EP) est suspecté sur la clinique +++ devant toute dyspnée, douleur thoracique ou malaise/syncope inexpliqué(e)… Toutes ces conditions justifient d’enregistrer rapidement un ECG pour écarter un diagnostic différentiel (notamment un syndrome coronaire aigu) [17]), éclairer le terrain cardiologique et modifier une hypothèse clinique d’EP. Néanmoins, même si certaines modifications de l’électrocardiogramme (ECG) sont plus fréquentes en cas d’EP, l’ECG seul n’est pas suffisamment sensible ou spécifique pour permettre ou exclure ce diagnostic [6].
Il est prudent de laisser le patient allongé tant que le patient n’a pas été bien évalué et qu’une embolie pulmonaire n’a pas été écartée (PT vidéo : YouTube).
Physiopathologie
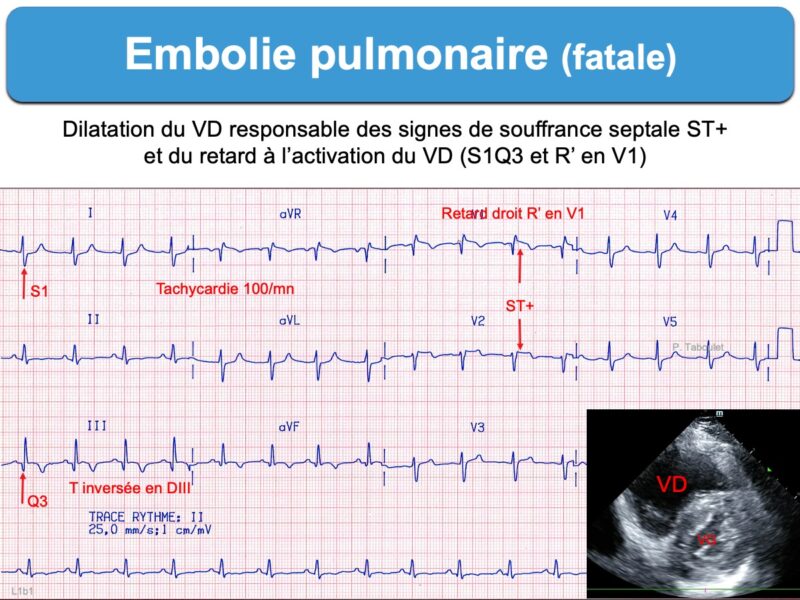
L’ECG n’est modifié qu’en cas d’EP suffisamment sévère pour entrainer un retentissement hémodynamique sur le cœur droit (oreillette et ventricule droits). La traduction sur l’ECG dépend du degré d’obstruction de l’arbre artériel pulmonaire et des antécédents cardiologiques et respiratoires du patient. Pour cette raison, il a peu de valeur pour écarter une hypothèse d’EP en cas d’obstruction peu sévère. De plus, les modifications peuvent s’observer au cours d’autres causes de cœur pulmonaire aigu ou d’autres pathologies.
Un ECG normal s’observe dans environ 30% des cas et ne doit jamais être utilisé pour écarter une hypothèse d’EP formulée cliniquement [1][8][11]. Il ne dispense pas du dosage des D-dimères et si besoin de l’imagerie.
Un ECG typique de cœur pulmonaire aigu renforce une hypothèse pré-test d’EP (théorème de Bayes) et oriente la stratégie diagnostique et thérapeutique en ce sens [6].
L’ECG du « cœur pulmonaire aigu » [1][2][10][18]
Dans le sens de la lecture de l’ECG, on peut observer :
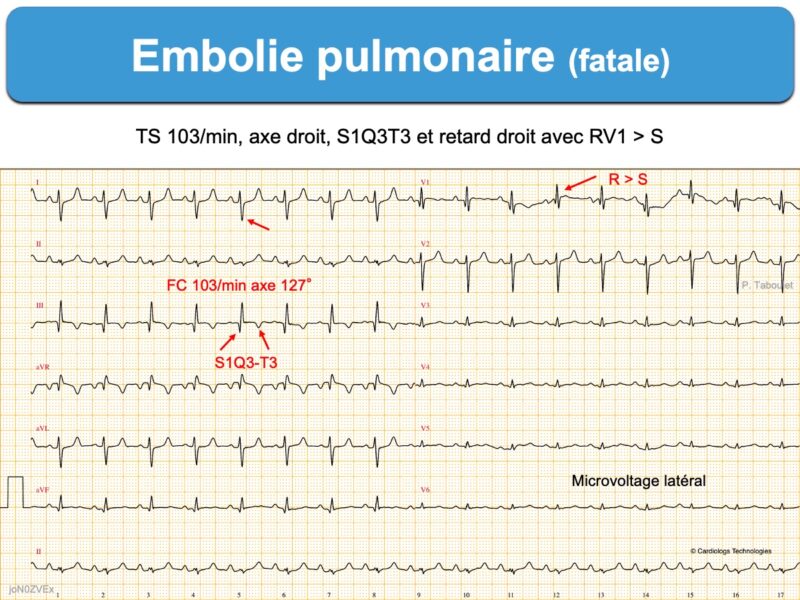
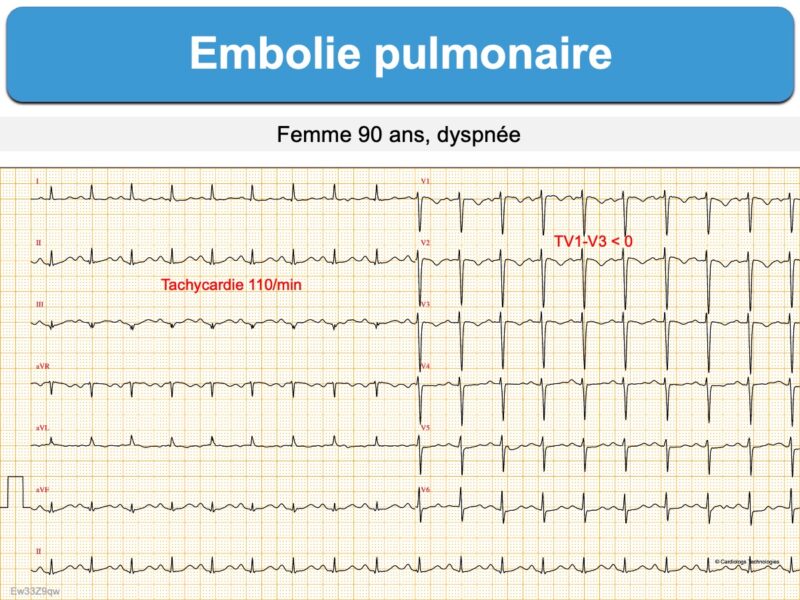
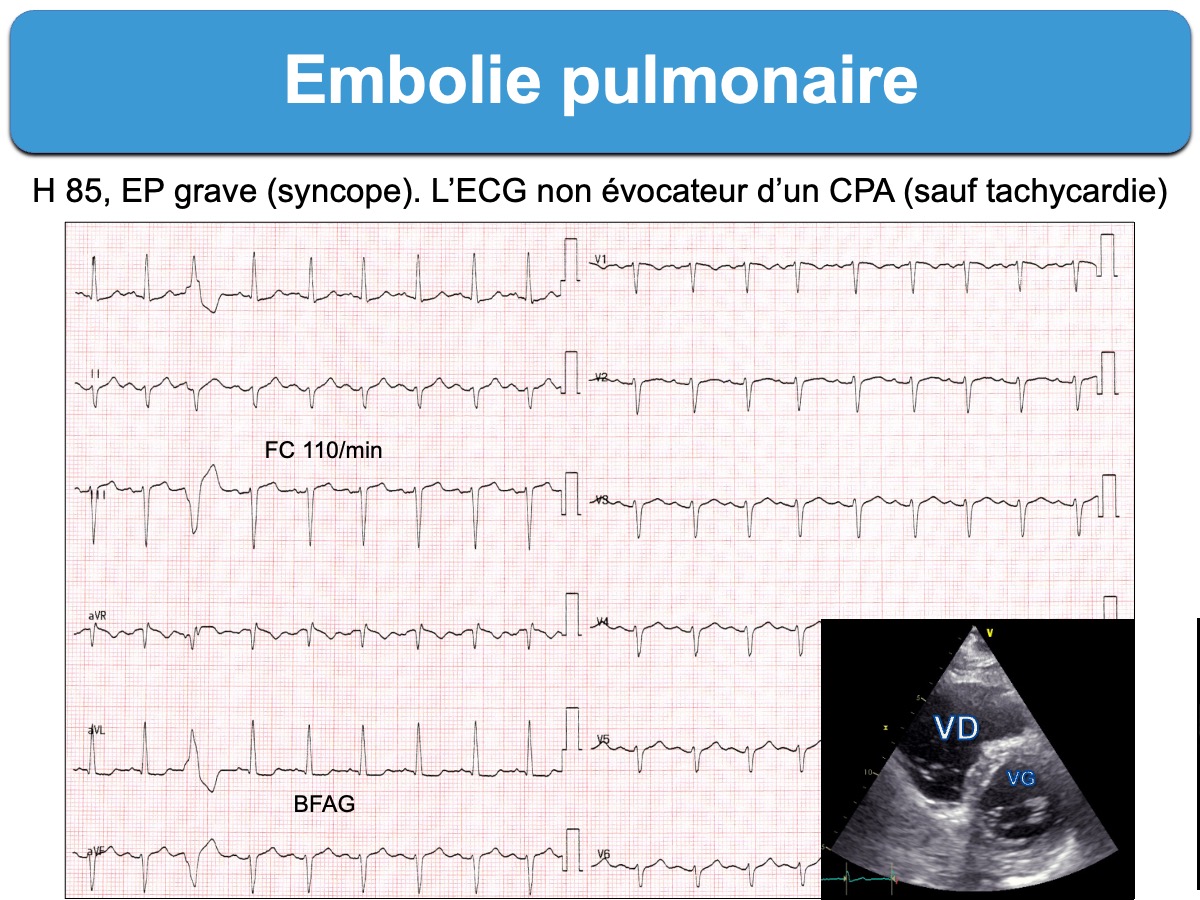
- tachycardie sinusale
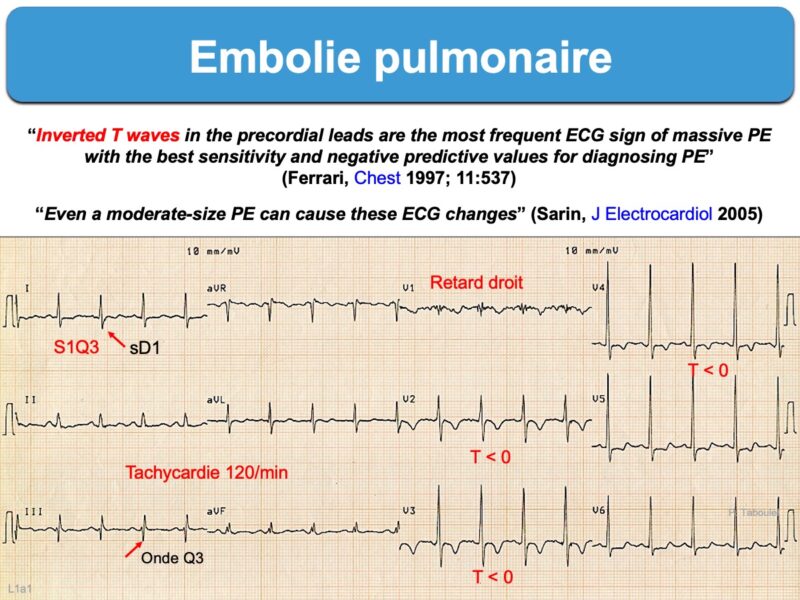
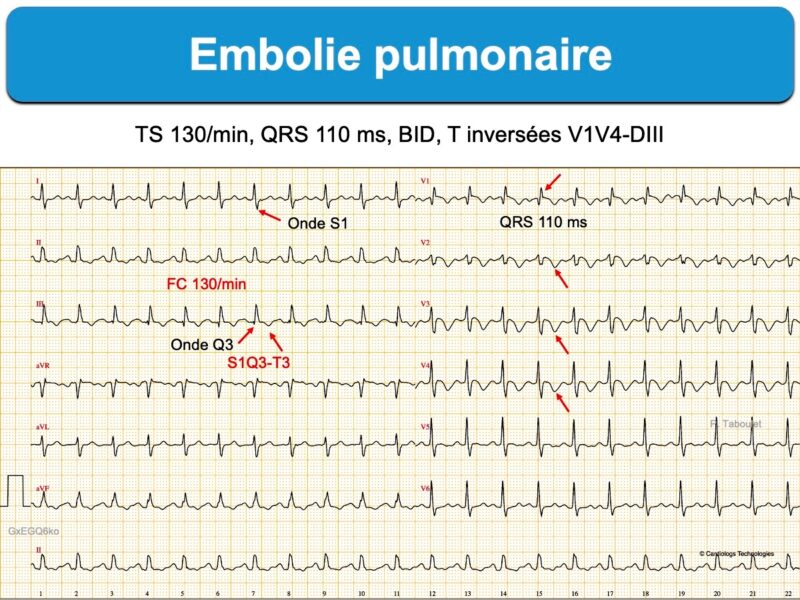
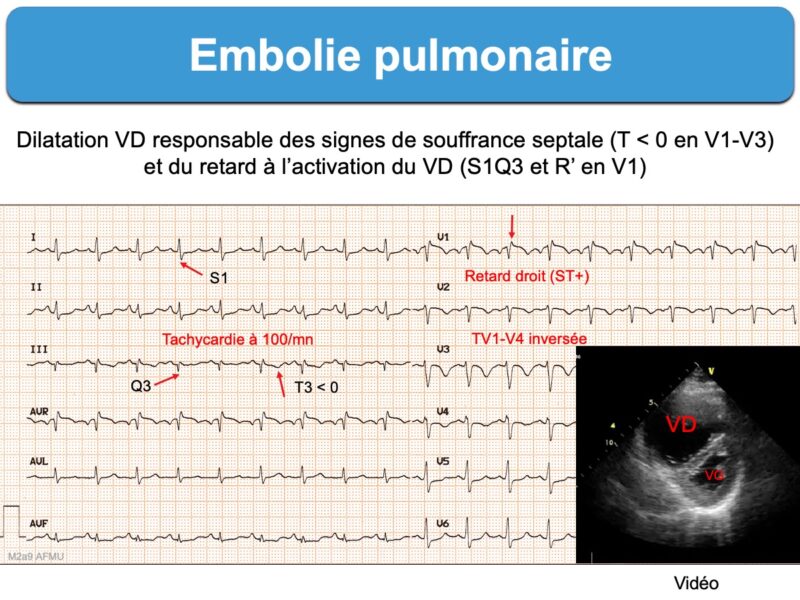
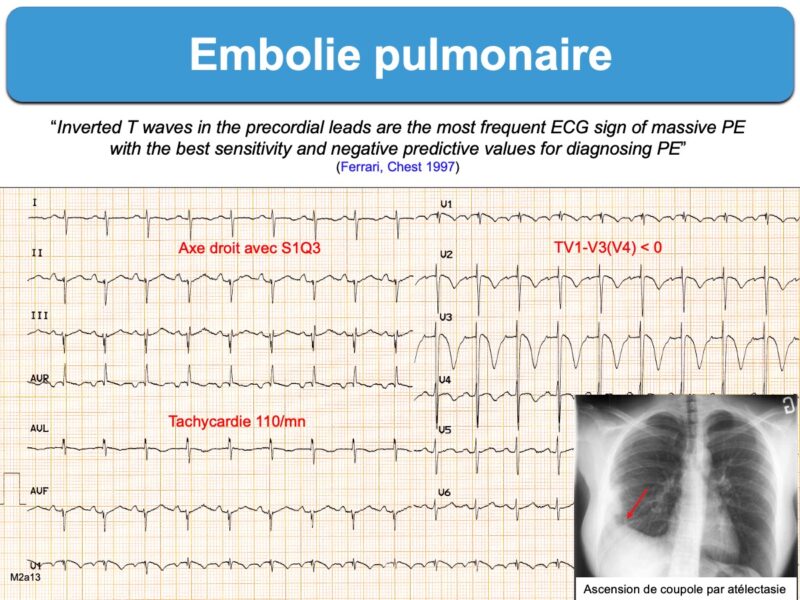
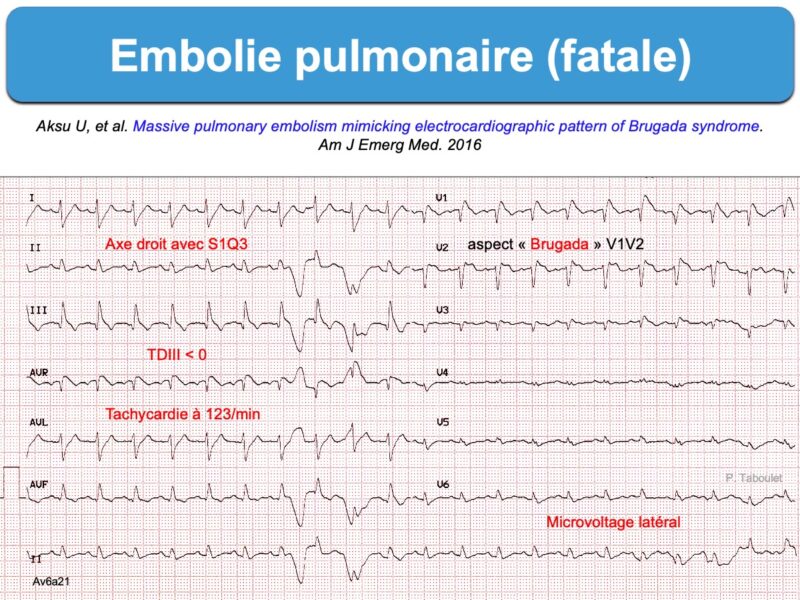
- S1Q3 (SDI ≥ R ou SDI profonde > 3 mm) avec présence d’une onde QDIII (parfois infarctoïde) qui atteste d’une dextrorotation ou, plus spécifique, le signe S1Q3(T3) avec présence d’une onde T inversée en DIII (littérature anglosaxone [2][2bis])
- déviation axiale droite des QRS [9]
- retard droit (RsR’ en V1) ou bloc de branche droit (incomplet ou complet)
- zone de transition des QRS tardive dans le précordium (vers V4-V5, voire V5-V6, biblio [1]).
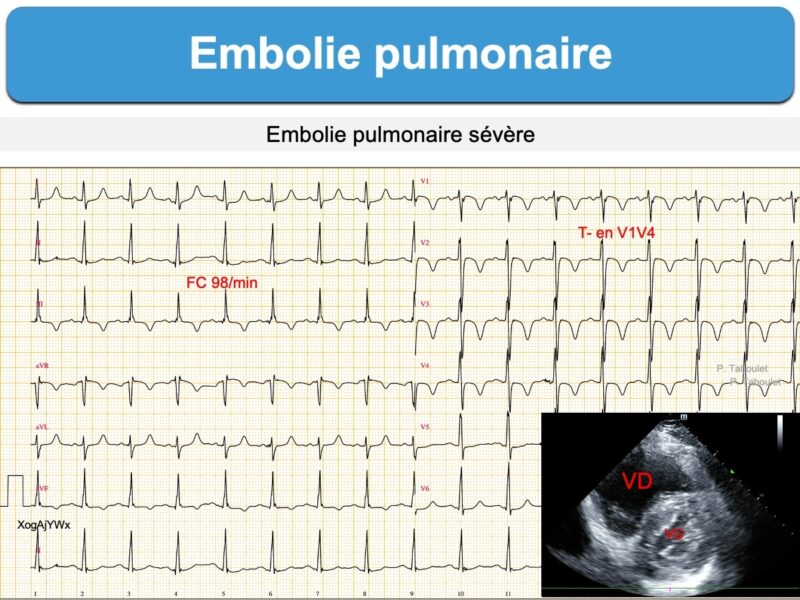
- ondes T inversées de V1 à V3(V4) et en DIII [3][9][10].
Chacun de ces signes a une sensibilité et une reproductibilité faibles [10].
L’apparition d’ondes T inversées (ou aplaties) en dérivations inférieures ou antéroseptales (1/3 des cas) avec une tachycardie (1/4 des cas) ou un S1Q3T3 seraient les signes les plus fréquents [2bis][3][8].
Plus il y a d’anomalies évocatrices, plus la probabilité d’embolie pulmonaire augmente et plus la probabilité qu’elle soit sévère augmente (Score de Daniel [10][13]).
D’autres signes de mauvais pronostic ont été rapportés (lire revues [15][13]).
- tachycardie avec surcharge ventriculaire droite (S1Q3T3, BID ou BBD ou ondes T inversées V1V4) [16][21]
- fibrillation atriale et autre tachycardie atriale [1][13][22]
- microvoltage des complexes QRS
- ST+ en V1(V3) avec parfois phénocopie d’ECG Brugada [4][5][25]
- ST+ en VR [7][14]
- sous-décalage de ST de V4 à V6, ST+ V1, ST+ III, Qr V1, HAD, FA [13] et parfois ST-T descendant « en marche d’escalier » (exceptionnel)
- apparition d’un bloc de branche droit (non démontré mais voir ci-dessous et [23]).
- une onde P pulmonaire (amplitude de PDII ≥ 2,5 mm)
Il faut souvent se contenter d’une fréquence cardiaque accélérée et d’un ou deux signes ECG évocateurs de souffrance septale ou de dextrorotation (ou une modification des tracés ECG précédents) pour renforcer une hypothèse d’embolie pulmonaire.
Diagnostics différentiels
- syndrome coronaire aigu :
- un aspect infarctus ST+ est possible en dérivation septales ou/et inférieures, lié à la souffrance ischémique (infarctus de type 2 [23]).
- toute tachycardie au cours d’une douleur thoracique, syncope ou dyspnée doit faire penser à une EP grave [24] !
- L’association d’une onde T inversée à la fois en V1 et DIII aurait la meilleure valeur diagnostique pour différentier EP (association +) et SCA (association -) [11][12].
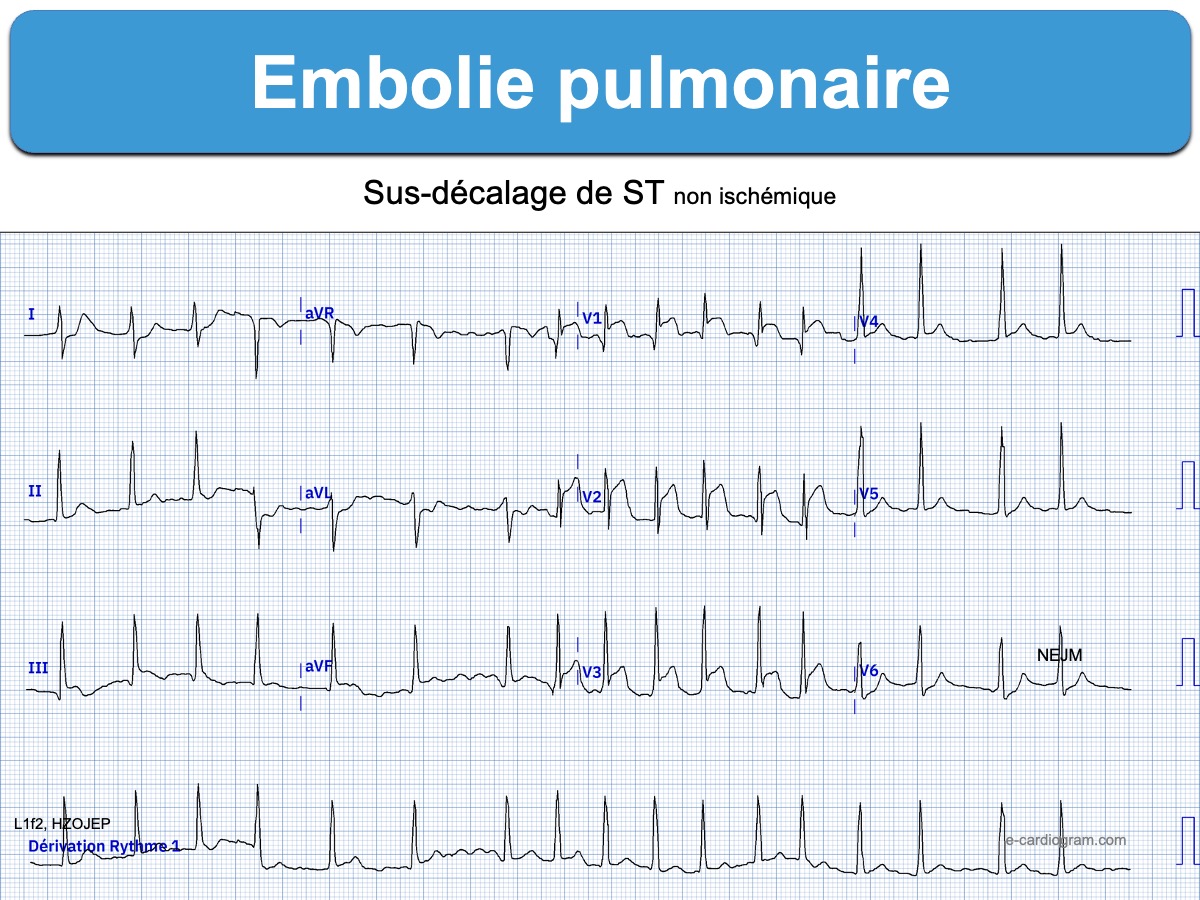
- agressions aiguës diverses : les anomalies du ST-T ne sont pas spécifiques [13] et se rencontrent au cours d’autres pathologies (BPCO/emphysème en poussée, asthme aigu grave, HTAP, cocaïne, anémie…) [9].
On n’affirme pas un diagnostic d’EP devant un ECG évocateur de cœur pulmonaire aigu car aucun signe n’est assez spécifique (nombreux faux positifs). En revanche, la présence d’un (et a fortiori plusieurs) signe évocateur de cœur pulmonaire aigu sur l’ECG augmente la probabilité post-test d’EP.
On n’écarte pas un diagnostic d’EP devant un ECG normal ou subnormal car l’ECG n’est pas une méthode diagnostique assez sensible (nombreux faux négatifs).
Raisonnement Bayesien : Andréa PENALOZA (Bruxelles, BELGIQUE) (video 15 min)
Biblio mise à jour sur PubMed ici
Blog de SW Smith (anglais)
- Echo d’une EP, ECG d’une EP
- Dyspnea on Exertion and a Positive Troponin
- Syncope and Flash Pulmonary Edema with T-wave Inversions in V1-V3
- Syncope, Shock, AV block, Large RV, “Anterior” ST Elevation….
- Syncope, Hypotension, and a Large Right Ventricle — What is the ECG Diagnosis?
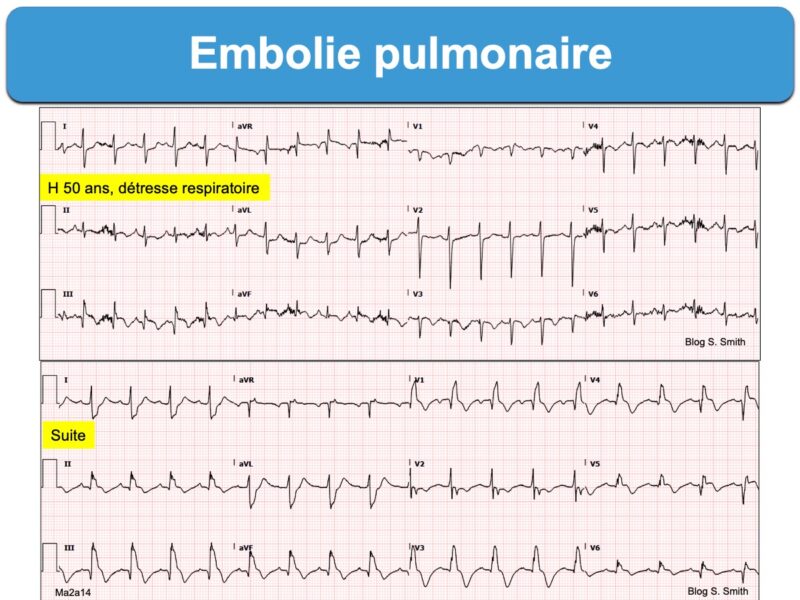
- A woman in her 50s with shortness of breath. Histoire typique mars 2022, ECG pathognomonique avec echo et scanner…
- Collapse, pulse present, ECG shows inferior OMI. ECGs, echo coeur et angiogramme super
- A 30-something with Chest pain and SOB avec un vrai S1Q3T3 (entre autre)
Cas cliniques détaillés
- Circulation 2020. A Chief Complaint of “I Am Going to Die!”
- LITFL: cas 104 (avec RX et scanner)
- Pillarisetti J, Gupta K. Giant Inverted T waves in the emergency department: case report and review of differential diagnoses. J Electrocardiol. 2010 Jan-Feb;43(1):40-2. This report describes an unusual case of moderate but not massive pulmonary embolism presenting with an ECG finding of giant inverted T waves. A review of the common conditions associated with such an ECG is also presented.
- Circulation. 2023 Feb 21;147(8):688-693 (Dyspnée progressive par pulmonary tumor thrombotic microangiopathy). Ostrominski JW, Bhatt DL, Scirica BM. Pulling Out All the Stops: A Case of Progressive Dyspnea. Histoire parfaitement commentée, cancer du sein, avec angio scanner normal (heureusement l’ECG est évocateur car fréquence cardiaque rapide et T inversées V2-V3-V4…)
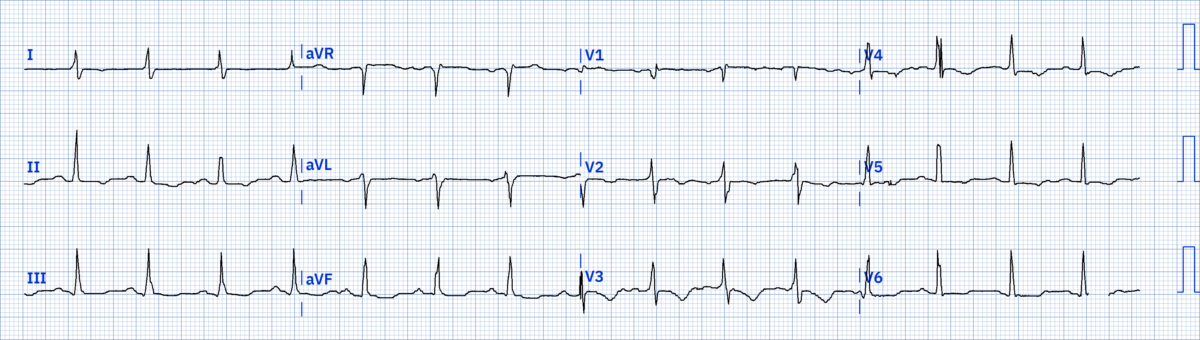
- Case report the permanent journal. ECG Diagnosis: Pulmonary Embolism.
TUC 2013 (Cours audio)
- Qu’est ce qui me fait penser à une EP… ou non ? Guy MEYER (Paris)
- Videos vimeo.com d’échocardio avec thrombus ou http://vimeo.com/user4022246
Intérêt du score PERC = 0 pour s’abstenir de doser les D-dimères [19][20]
- Si moins de 50 ans, pouls <100 battements / min, SpO2 > 94%, pas de gonflement unilatéral des jambes, pas d’hémoptysie, pas de chirurgie ou de traumatisme dans les 4 semaines, pas de thrombose veineuse profonde ou d’embolie pulmonaire antérieure, et pas d’utilisation d’hormone orale.
- Bon score mais qui a montré des limites…
Références et annotations (réservées aux abonnés)
La suite est réservée aux membres et stagiaires du site.
Connexion | Devenir membre | Devenir stagiaire
La suite est réservée aux membres et stagiaires du site.
Connexion | Devenir membre | Devenir stagiaire