Activité ventriculaire prématurée, originaire du myocarde ventriculaire et parfois du faisceau de His ou des fibres de Purkinje (ESC 2022 et 2025 [1], livre [2]). L’influx dépolarise les ventricules de proche en proche et remonte par voie rétrograde vers le nœud AV, via les fibres de Purkinje et le faisceau de His. Il peut y rester bloqué ou gagner les oreillettes qu’il dépolarise de façon rétrograde.
Synonymes. Ectopie ventriculaire ou dépolarisation ventriculaire prématurée (CIM 10). Anglais. Premature ventricular complex.

Les ESV peuvent s’observer à tout âge. Elles sont rares chez l’adulte jeune, mais leur fréquence augmente avec l’âge [5]. Au delà de 50 ans, 50% des gens ont au moins une ESV/jour.
Dans la grande majorité des cas, les ESV sont bénignes et idiopathiques et les patients asymptomatiques. Ailleurs, ils expriment des palpitations gênantes et veulent être rassurés sur l’absence de risque de mort subite.
La démarche clinique débute par l’interrogatoire et l’examen physique. L’ECG permet l’analyse précise des ESV et la recherche d’une pathologie rythmique ou structurelle (cf. cardiomyopathie, cardiopathie ischémique…). La biologie peut aider à repérer un facteur favorisant (anémie, hyperthyroïdie, hypokaliémie). Un Holter des 24 h précise leur nombre et guide la démarche ultérieure. Chez un patient symptomatique ou asymptomatique, les seuils acceptables sont < 250 à 500 ESV par jour. En cas de symptômes gênants, d’examen clinique ou ECG anormal ou de Holter anormal, il est recommandé de prendre l’avis d’un cardiologue pour évaluer le caractère bénin des ESV, écarter l’existence d’une pathologie cardiaque structurelle et évaluer l’intérêt d’un traitement spécifique [1].
Diagnostic ECG
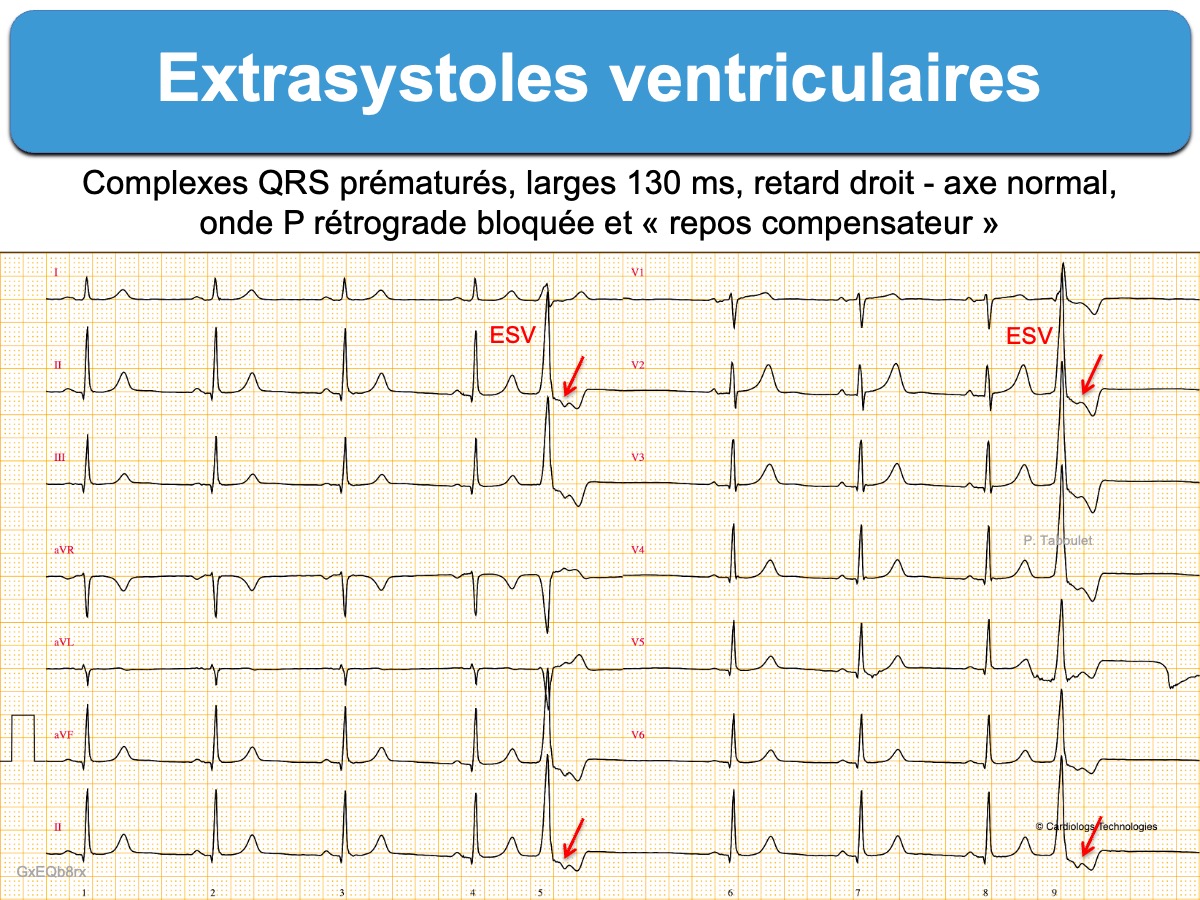
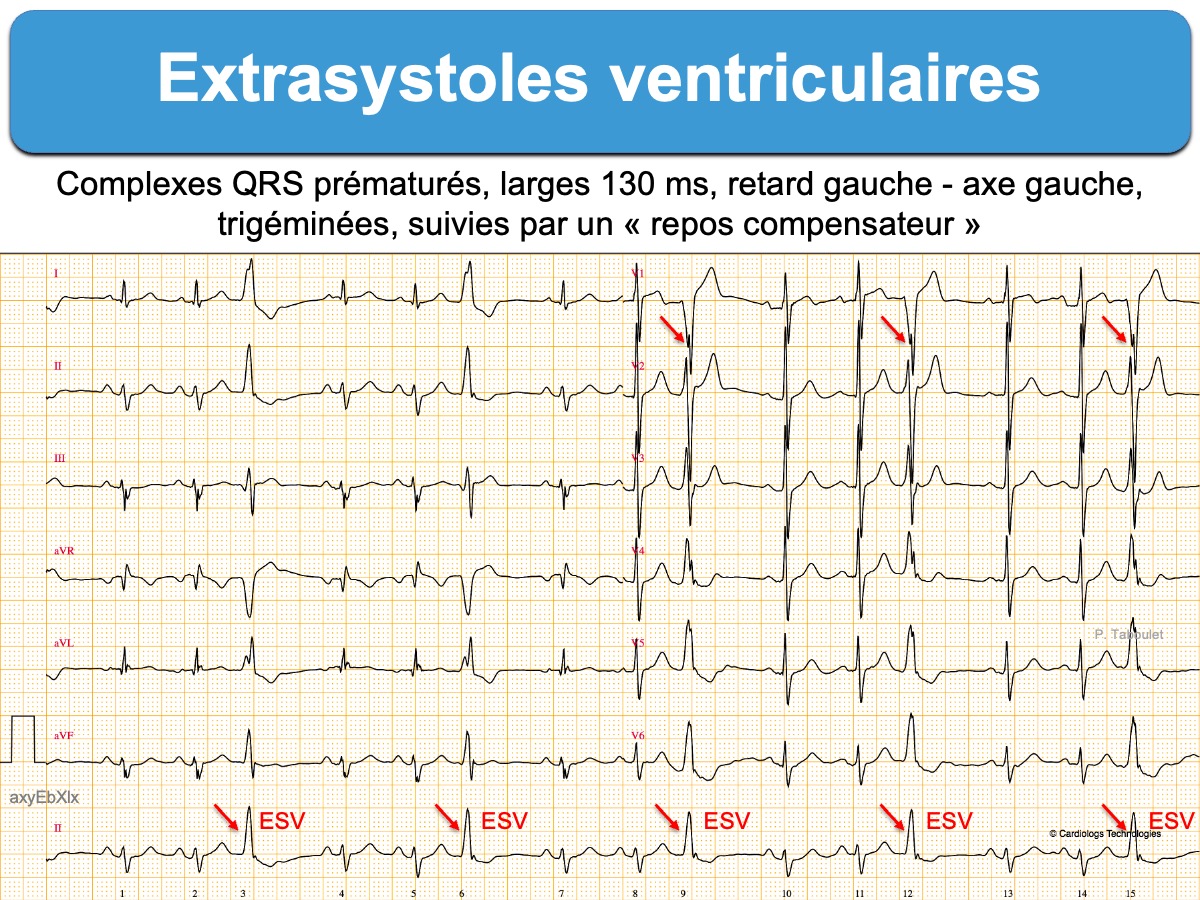
Il existe un complexe QRS prématuré, plus large que le complexe QRS en rythme sinusal.
-
- Si l’influx à l’origine de la primo dépolarisation du ventricule remonte par voie rétrograde vers le nœud AV et dépolarise les oreillettes, le complexe QRS est suivi par une onde P rétrograde, visible ou masquée dans la repolarisation. Dans ce cas, l’activation de l’oreillette droite réinitialise le nœud sinusal ce qui décale l’activité sinusale ultérieure et le complexe QRS post-extrasystolique (« repos compensateur » ou pause post-extrasystolique).
-
- Si l’influx rétrograde reste bloqué dans le nœud AV, la régularité des ondes P n’est pas modifiée et le complexe QRS sinusal post-extrasystolique (ou « complexe ultérieur ») n’est pas décalé. On parle alors d’extrasystole interpolée (interpolated ventricular extrasystole).

-
- Si les ventricules sont dépolarisés simultanément par un influx supraventriculaire et un influx ventriculaire ectopique, le complexe QRS hybride résultant est appelé complexe de fusion, différent et moins large qu’un complexe QRS ectopique.
Aspects ECG possibles et schématisation à l’aide d’un dromograme.
La repolarisation est toujours altérée avec un décalage du segment ST opposé au sens de la déflexion principale du QRS (cf. Discordance appropriée).
L’origine de l’ESV doit être précisée à l’aide de son amplitude, sa durée (largeur), son axe dans le plan frontal et son aspect en dérivation V1.
- Les ESV amples et peu élargies (0,10 à 0,12 s) sont issues de la partie haute du septum interventriculaire ou du His.
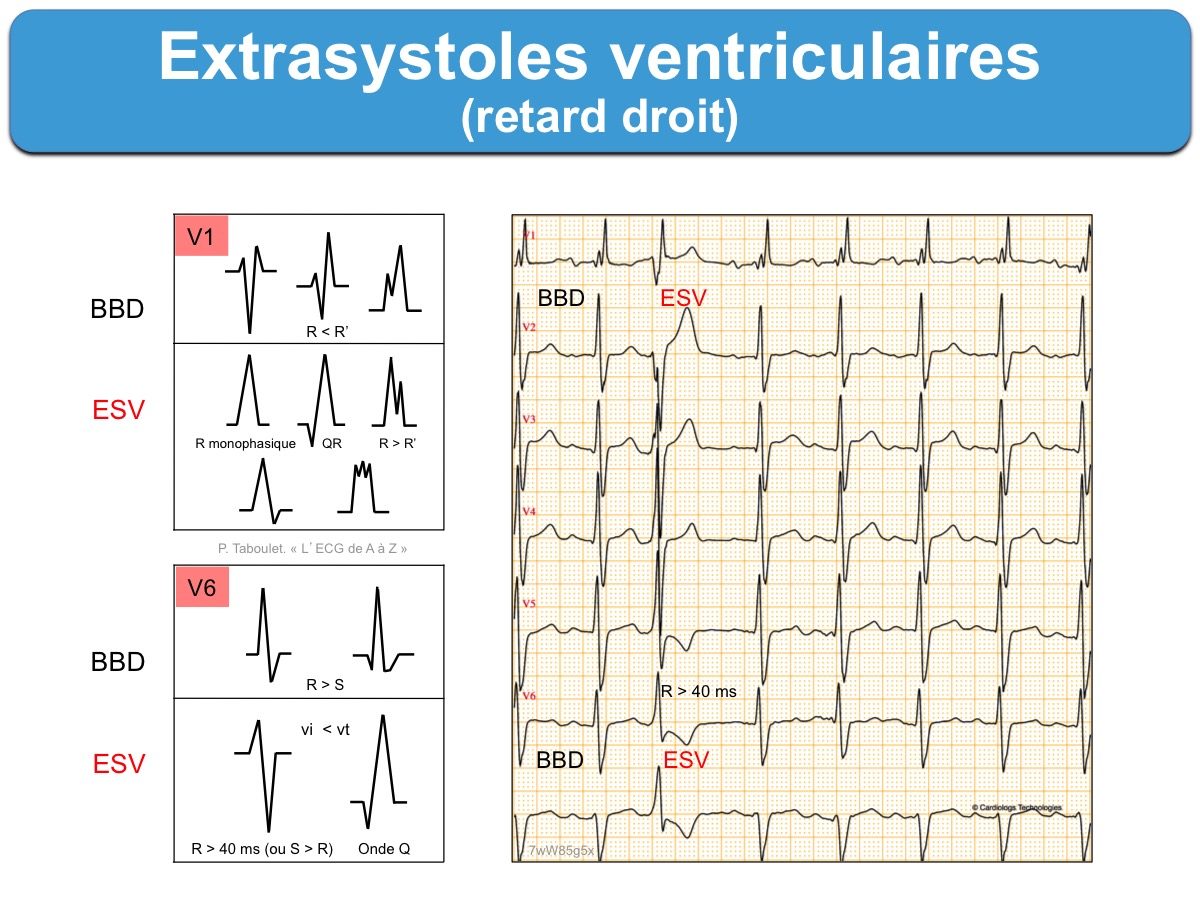
- Les ESV qui ont une prédominance positive en V1 (retard droit) proviennent du ventricule gauche (ESV avec retard droit).
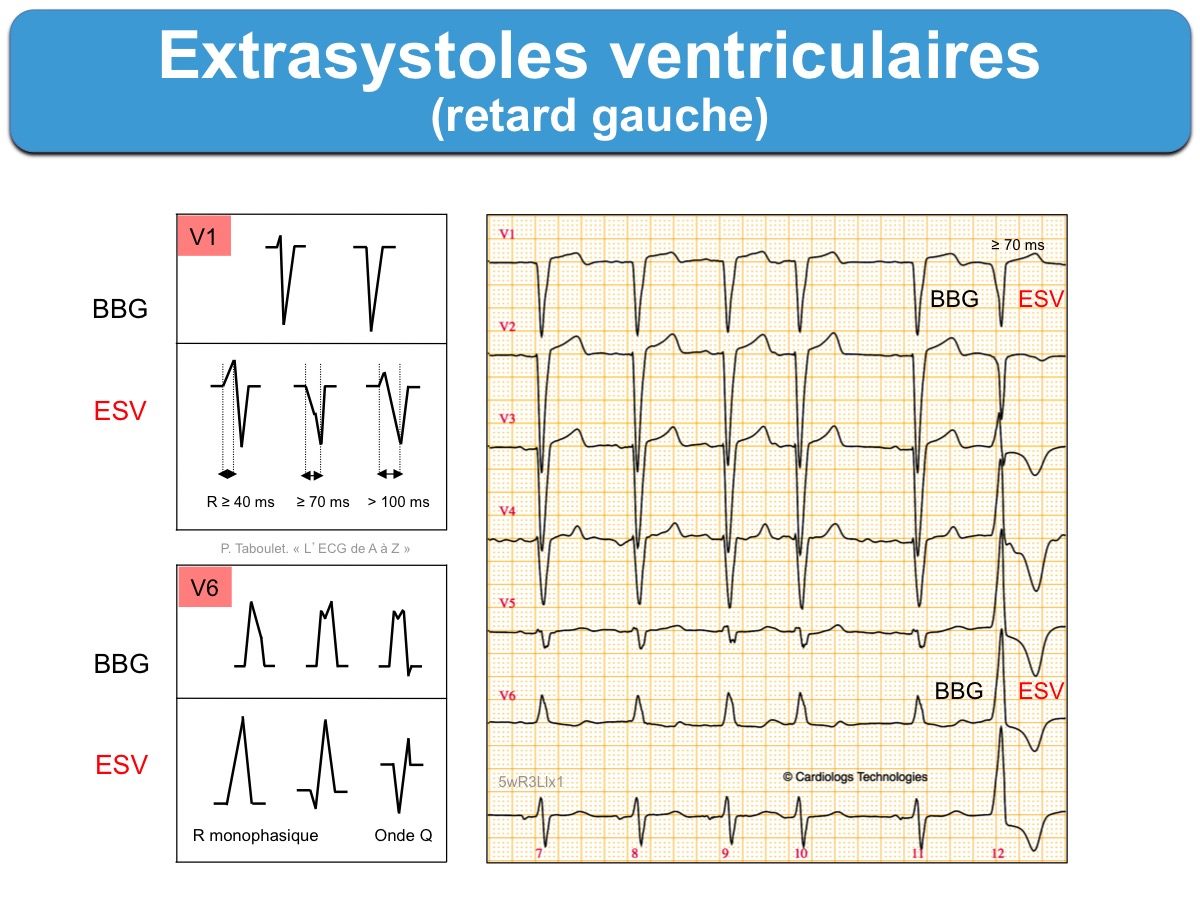
- Les ESV qui ont une prédominance négative en V1 (retard gauche) proviennent du ventricule droit ou du septum (ESV avec retard gauche). Si l’axe est dévié à droite (DI négatif), elles proviennent de la partie antérieure de division de la branche gauche et si l’axe est dévié à gauche (DI positif), elles proviennent de la partie postérieure de cette division. Si elles sont isoélectriques en V1, elles sont originaires du septum gauche ou droit ou d’une cusp aortique.
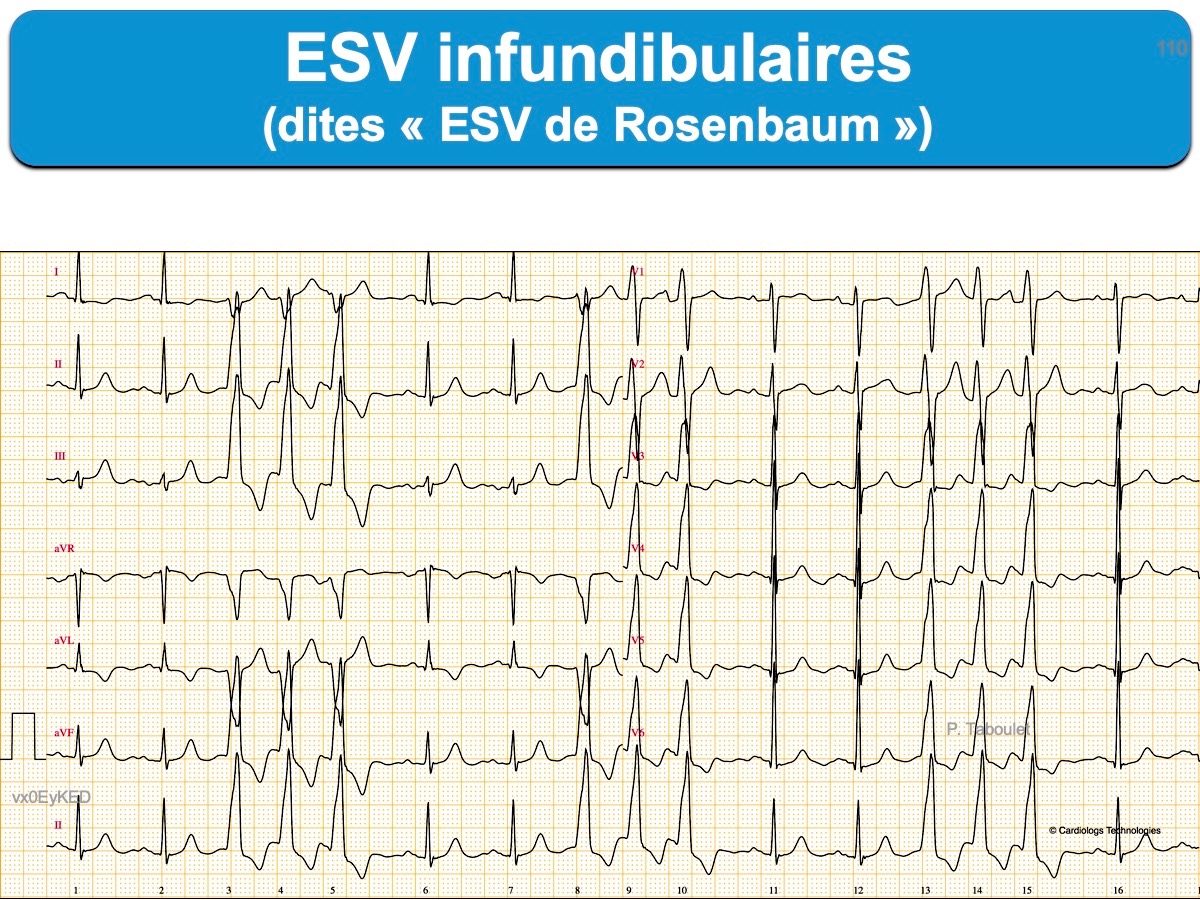
- Les ESV originaires du ventricule droit en l’absence de cardiopathie structurelle sont plus souvent bénignes que celles originaires du ventricule gauche (cf. ESV infundibulaires qui ont un retard gauche axe droit/inférieur). Elles s’observent chez des sujets sains dans presque 1% des cas (retard gauche trois fois plus fréquent que retard droit), plus fréquemment avec l’âge [4][6]. Elles peuvent être néanmoins très symptomatiques.
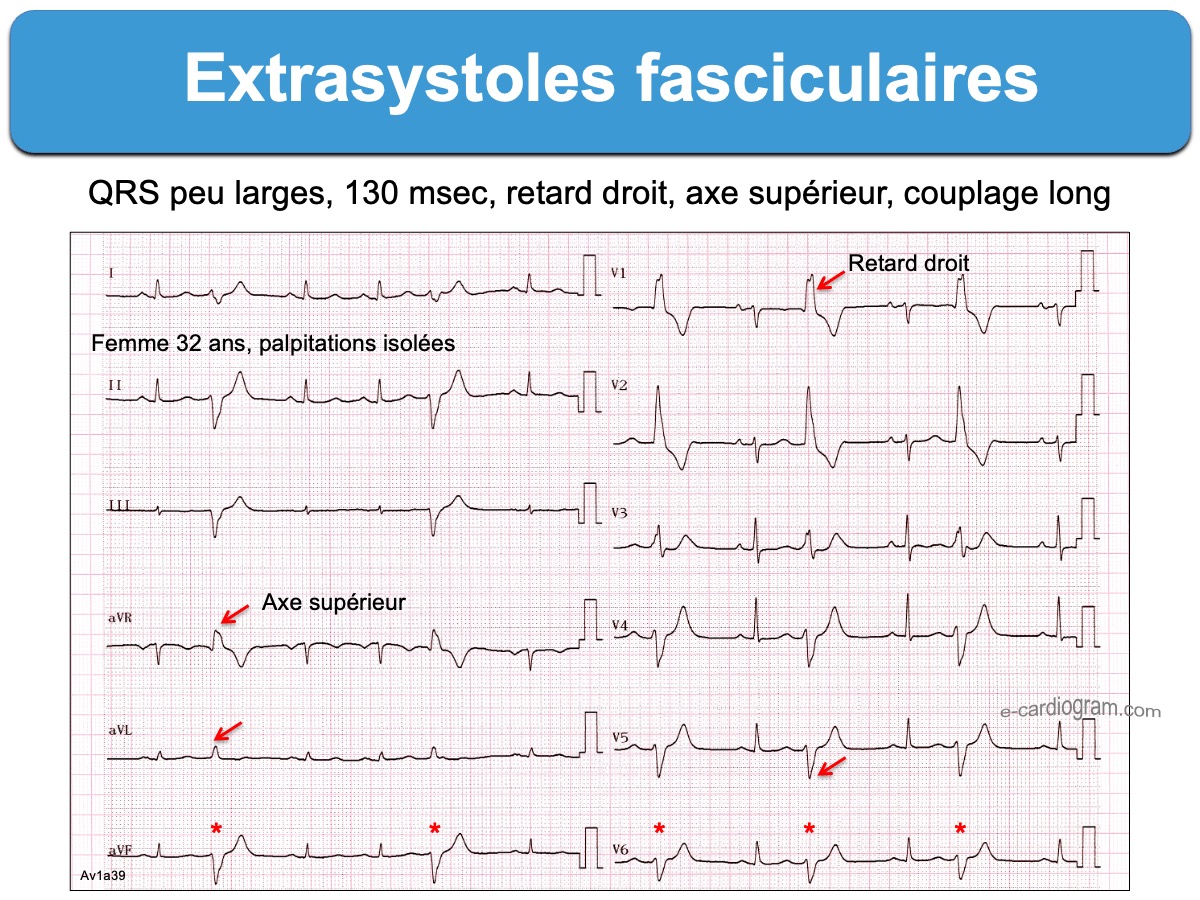
- Les ESV originaires du VG de type fasciculaire (ex. retard droit-axe hypergauche en VR-VL) en général) sont généralement bénignes, mais peuvent être tres symptomatiques (cf. ESV fasciculaires).
- Les ESV du système de Purkinje droit (généralement monomorphes) ou gauche (morphologie qui peut changer d’un battement à l’autre) : rares, dangereuses, car couplage court 240-320 ms avec risque de phénomène R sur T et FV). Ces ESV sont dites malignes, car responsables d’arythmie ventriculaire (cf. Extrasystoles ventriculaires malignes).
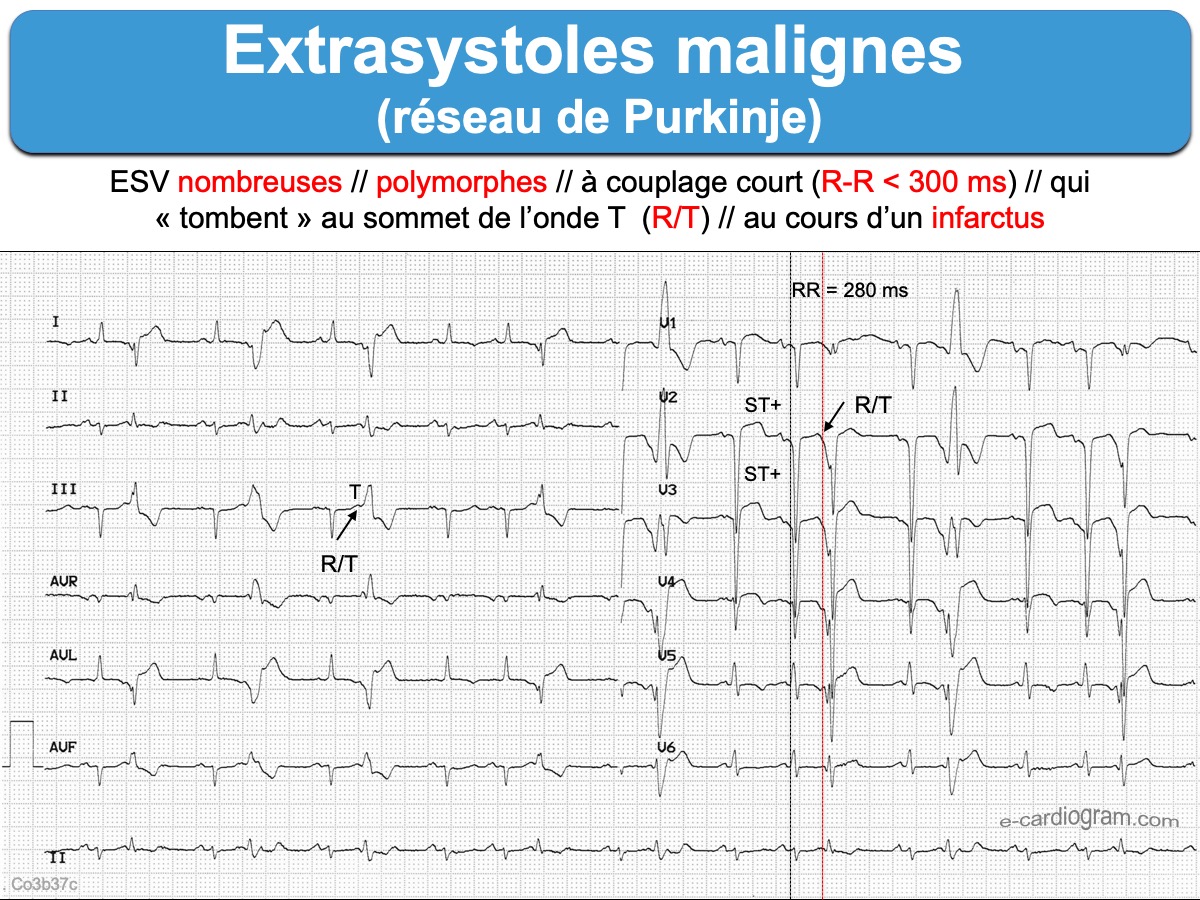
- De nombreux facteurs, dont l’état du myocarde, compliquent parfois la recherche de l’origine d’une ESV ou d’une TV [7].
L’aspect des ESV doit être précisé. Les ESV monomorphes sont plus souvent bénignes que les ESV polymorphes (≥ 3 aspects). Le type de retard droit ou gauche et l’axe (droit, gauche…) guide vers l’origine du foyer ventriculaire et permet la distinction avec un bloc de branche droit ou gauche (cf. ESV avec retard gauche, ESV avec retard droit). Les ESV larges avec une pente lente de l’ascension jusqu’au pic est en faveur d’une origine épicardique.
Le couplage des ESV doit être précisé. Le couplage peut être long (index de prématurité RR/QT est > 1 ou R-R > 350 ms, de bon pronostic) ou court (index de prématurité RR/QT est < 0,85 ou couplage < 300 ms, de mauvais pronostic) avec, ou non, phénomène R/T; il peut être fixe (bon pronostic) ou variable (mauvais pronostic) (voir MORT en DIRECT ?).
La fréquence des ESV est difficile à préciser sur un ECG standard et elle est variable d’un jour à l’autre.
- On précisera leur nombre par tracé, par heure ou mieux par jour (charge en ESV, variations nycthémérales), leur alternance éventuelle avec un ou plusieurs complexes de base (cf. Bigéminisme) et leur caractère répétitif (doublets, triplets, salves) (cf. ECG Holter).
- Le comptage par ECG ambulatoire est plus précis et peut emporter la décision de traitement. En effet, des ESV très nombreuses peuvent conduire à une cardiomyopathie rythmique (au moins 15–25% du nombre de battements totaux) ou interférer avec l’hémodynamique en cas de resynchronisation ventriculaire. Si les ESV sont ou semblent fréquentes (ex. Holter ECG ≥ 10 ESV/h voire ≥ 500 ESV/24 h, une échocardiographie transthoracique est recommandée pour rechercher une cardiopathie structurelle, suivie éventuellement d’une IRM cardiaque. D’autres examens existent orientés par la clinique et ces premiers examens, et notamment une épreuve d’effort (Voir ci-dessous) [1].

Le substrat à l’origine des ESV
Après l’analyse des ESV, l’évaluation se poursuit par la recherche de signes ECG en faveur d’une cardiopathie structurelle ou rythmique
Par exemple (Dr. Raffaele Scorza, FESC [1])
- A prolonged or shortened QT interval may suggest electric disease on genetic (Short or Long QT-syndrome) or on acquired basis.
- A Brugada pattern with coved ST-elevation followed by negative T-wave can be seen in V1-V3.
- High QRS-amplitude in precordial leads may result from hypertrophic myocardium.
- Precordial T-wave inversion or so-called epsilon wave (a late potential embedded in the end of the QRS-complex) may indicate arrhythmogenic right
- ventricular cardiomyopathy (ARVC).
- Pathological Q waves might reflect scarred areas, most commonly due to previous myocardial infarction.
- Conduction disease (prolonged PQ- or QRS-time) may manifest because of cardiac disease.
L’évaluation ultérieure comprend une analyse des antécédents familiaux, des comorbidités et un bilan morphologique (échocardiographie, souvent IRM, pet-scan (avec traceur), angiographie du VD, EE, exploration électrophysiologique, genetic testing, angiographie…) (ESC 2022 [1]).
Causes et facteurs favorisants [1]
- Maladies structurelles (fibrose, cardiomyopathie, infarctus, etc.), mais aussi parfois des pathologies non cardiaques : hyperthyroïdie, hypokaliémie, myopathies (ex : dystrophie myotonique), sarcoïdose, maladie de Chagas.
- Stress, anxiété (via une hyperactivation sympathique), prise de stimulants (caféine, alcoolisation aiguë, tabac) sont des facteurs déclenchants.
- Apnées du sommeil, obésité et usage de drogues sont également à considérer.
Astuces et pièges
- Une ESV plutôt fine peut correspondre à un complexe de fusion si une onde P la précède de peu et parvient à dépolariser simultanément les ventricules.
- Une ESV moins large qu’un complexe QRS large d’origine sinusale avec bloc de branche peut correspondre à une origine septale, infundibulaire ou fasciculaire ou une exceptionnelle fusion normalisante si une extrasystole ventriculaire dépolarise le ventricule homolatéral au bloc au même instant que l’autre ventricule est dépolarisé normalement (cf. Complexe de fusion).
- En cas d’extrasystole interpolée (non décalante), l’intervalle PR consécutif peut être allongé en raison d’un ralentissement de la conduction antérograde des influx atriaux dans le nœud AV sous l’influence de la conduction rétrograde de l’influx ventriculaire (« conduction cachée » ou « concealed retrograde conduction », voir schéma) [6].

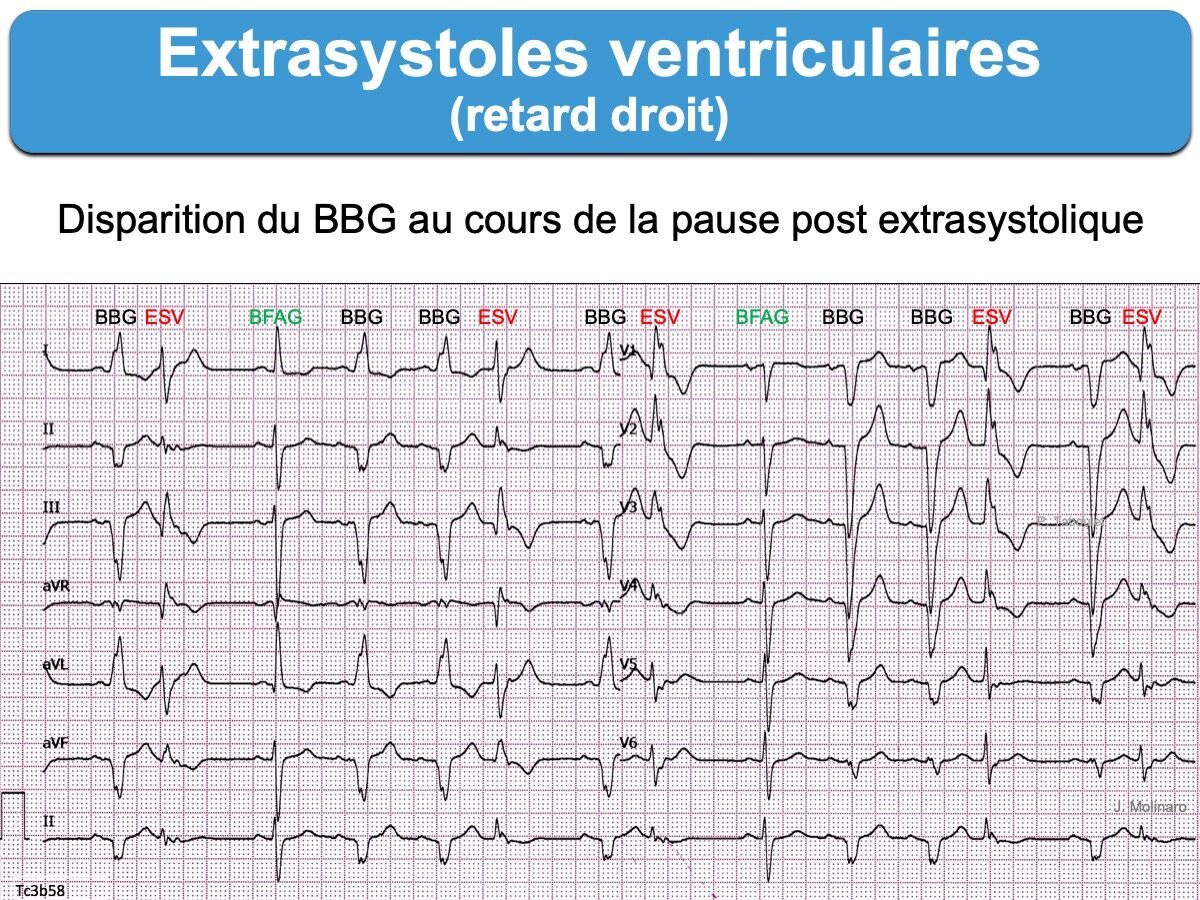
- Une « pause post extrasystolique » peut améliorer la conduction intraventriculaire ultérieure dans le faisceau de His et permettre la sortie de sa période réfractaire (régression d’une aberration ventriculaire) ce qui affine le QRS transitoirement (voir ci-dessous). A l’inverse, une pause peut aggraver la conduction ultérieure si une branche du faisceau de His se dépolarise lentement durant la pause et ne peut plus se dépolariser quand arrive l’influx suivant (cf. Bloc en phase 4) ce qui élargit le QRS transitoirement.
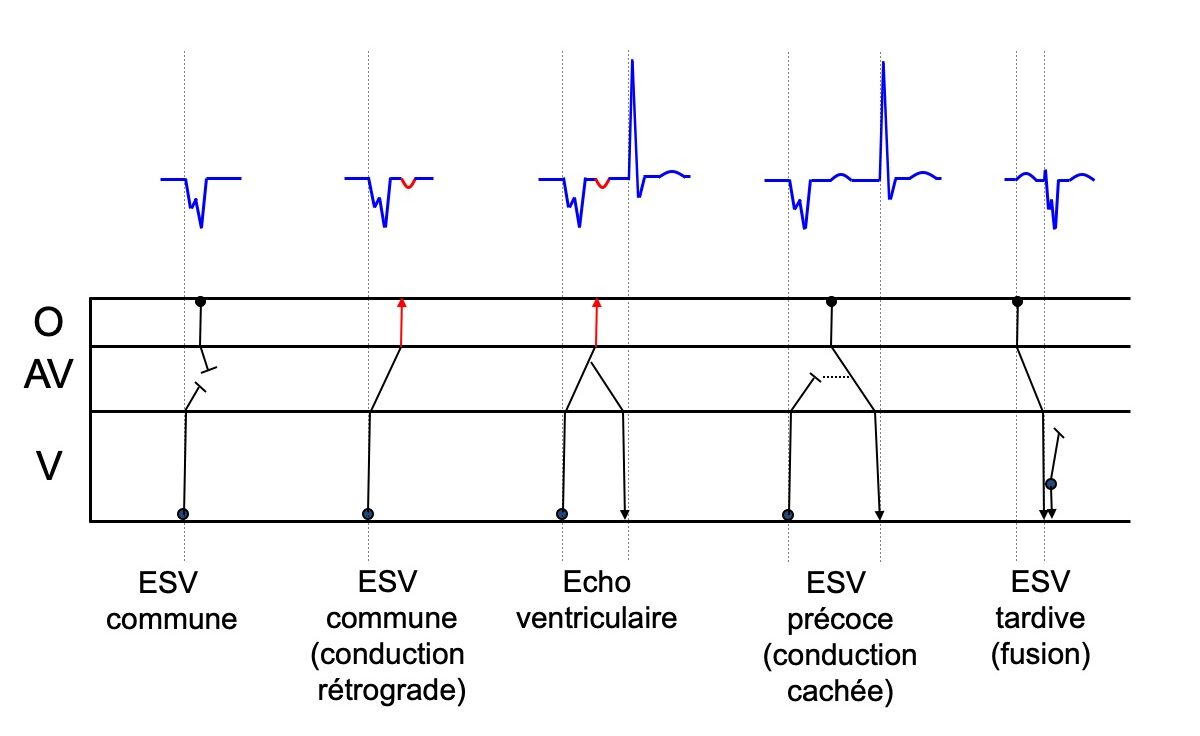
- Une ESV peut simuler un bloc AV ou un bloc SA. En effet, toutes les extrasystoles influencent plus ou moins la conduction intracardiaque sus- et sous-jacente et peuvent générer des aspects de pseudo-blocs (voir dromogrammes ci-dessous).

Figure A. Une extrasystole atriale très précoce reste bloquée dans le nœud AV. Elle est responsable de l’allongement du temps de conduction Intranodale de l’impulsion suivante (allongement du PR)
Figure B. Une extrasystole atriale plus tardive (ou moins précoce) allonge tellement la conduction dans le NAV que l’onde sinusale suivante est bloquée.
Figures C et D. Mêmes phénomènes qu’en A et B, après la survenue d’une extrasystole ventriculaire plus ou moins précoce. De plus, Figure D, après l’ESV l’onde sinusale est bloquée et survient une extrasystole jonctionnelle dont la propagation vers l’oreillette est bloquée, ce qui crée, au niveau du nœud, un état réfractaire qui interdit la conduction de l’influx sinusal suivant
Figure E. Une extrasystole jonctionnelle dont la propagation rétrograde vers l’oreillette est bloquée crée au niveau du nœud AV un état réfractaire qui interdit la conduction de l’influx sinusal suivant.
Figure F. Une extrasystole jonctionnelle cachée qui n’atteint ni le ventricule ni l’oreillette (et ne peut donc avoir de traduction électrique) peut, seule, expliquer le trouble de conduction qui s’extériorise pour l’influx suivant.
- Une « pause post extrasystolique » peut démasquer une activité électrique atriale (rythme sinusal ou tachycardie atriale) à même d’expliquer certaines tachycardies inclassables [3] ou des anomalies de repolarisation du complexe post extrasystolique impliquées dans les arythmies ventriculaires (lire article passionnant) [8]).
Diagnostics différentiels
La survenue d’un complexe QRS large ± prématuré peut correspondre à :
- Une aberration ventriculaire suite à une ESA bloquée partiellement dans le faisceau de His (cf. ESA (ou ESJ) conduite avec aberration ventriculaire)
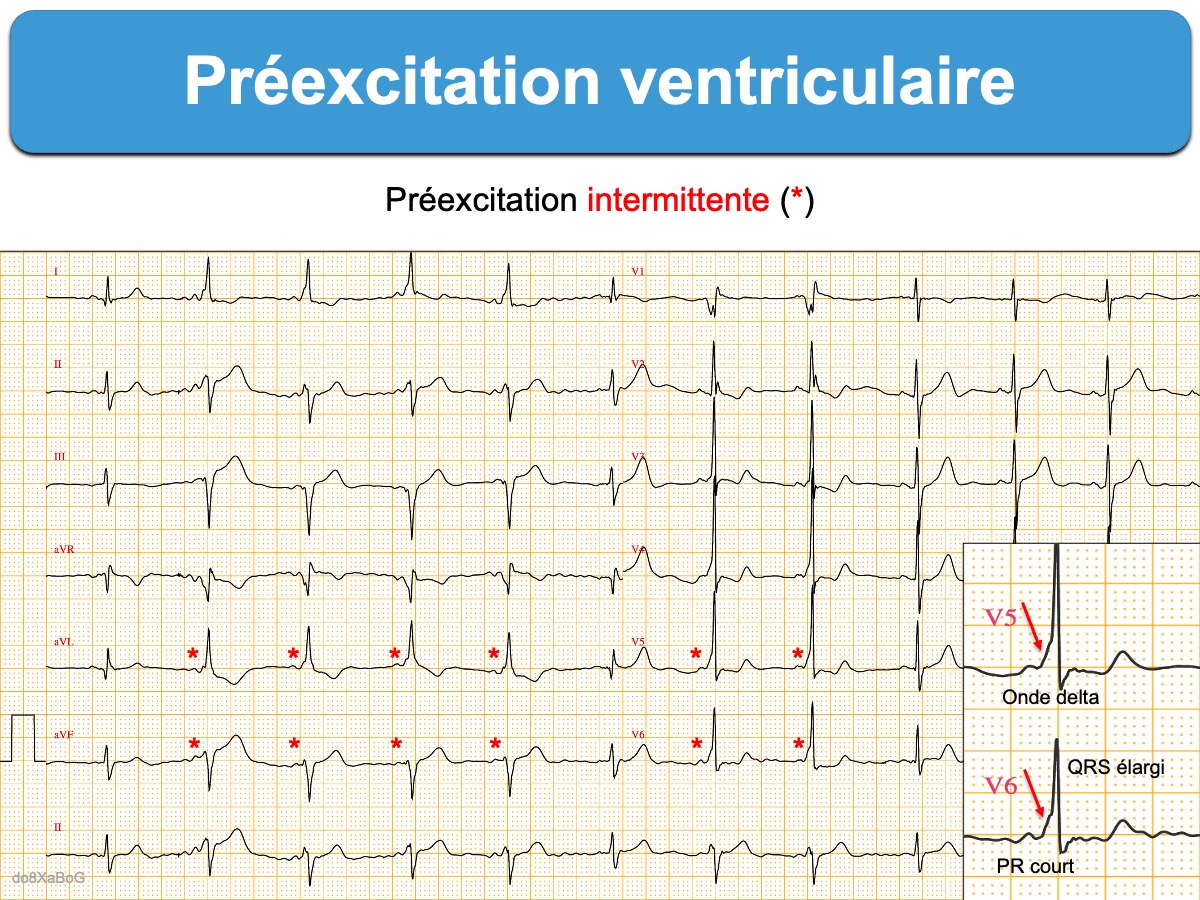
- Une préexcitation ventriculaire intermittente
BILAN
L’évaluation initiale du pronostic des extrasystoles ventriculaires (ESV) est centrée principalement sur la recherche d’une cardiopathie structurelle ou une anomalie de l’électrogénèse (ESC 2022 [1]): examen clinique (symptômes, terrain personnel et familial, syncope, relation avec l’effort…); ECG (typologie et couplage des ESV, anomalie de l’électrogénèse, intervalle Q-T, cardiopathie structurelle…) ; biologie (potassium au minimum, NTproBNP et TSH selon clinique et terrain.
Le bilan cardiologique initial n’est entrepris qu’en cas de symptômes, ESV fréquentes (≥ 250-500/24 h), anomalie de l’électrogénèse ou en cas de suspicion de pathologie structurelle, en particulier ischémie coronaire ou cardiomyopathie… [2].
- Échocardiographie (hypertrophie, analyse de la cinétique régionale, fraction d’éjection VG, valvulopathies, cavités droites, pression systolique dans l’artère pulmonaire…)
- ECG Holter de longue durée (fréquence et couplage des ESV ou salves de TV, comportement catécholergique…).
- Épreuve d’effort pour rechercher des arguments en faveur d’une ischémie coronaire, une TV cathécolergique ou une cardiomyopathie arythmogène du VD…
Le bilan cardiologique ultérieur varie selon l’origine des ESV, guidée par l’ECG et le bilan cardiologique initial.
- En présence d’ESV avec retard gauche (originaire du VD) ou dans le bilan d’une cardiomyopathie dilatée : scintigraphie myocardique, coroscanner, IRM cardiaque avec gadolinium voire coronarographie à la recherche d’une cardiopathie ischémique ou cicatrice de myocardite…
- En présence d’ESV avec retard droit (originaire du VG) ou anomalie du ventricule droit ou prolapsus mitrale [3] révélé par l’échocardiographie : IRM cardiaque, mais surtout scintigraphie de phase ± angiographie VD à la recherche d’une cardiomyopathie arythmogène du VD (parfois recherche des potentiels tardifs ventriculaires).
- Selon la clinique on peut discuter un PET-scan: Myocardite? Sarcoïdose? Vascularite?
Au terme du bilan, on pourra distinguer les extrasystoles ventriculaires bénignes des extrasystoles ventriculaires malignes et mieux apprécier le risque de survenue d’une arythmie ventriculaire.
[1] Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022 Oct 21;43(40):3997-4126. (téléchargeable)
Pedersen CT, Kay GN, Kalman J, et al. EHRA/HRS/APHRS expert consensus on ventricular arrhythmias. Europace. 2014 Sep;16(9):1257-83. (téléchargeable)
[2] Extramiana JFC : Conférence on line
[3] Basso C. Perazzolo Marra M. Rizzo S. et al. Arrhythmic mitral valve prolapse and sudden cardiac death.Circulation. 2015; 132: 556-566 (téléchargeable) –> MVP is an underestimated cause of arrhythmic SCD, mostly in young adult women. Fibrosis of the papillary muscles and inferobasal left ventricular wall, suggesting a myocardial stretch by the prolapsing leaflet, is the structural hallmark and correlates with ventricular arrhythmias origin. Contrast-enhanced cardiac magnetic resonance may help to identify in vivo this concealed substrate for risk stratification.
Vidéos YouTube. P. Taboulet
- 10a. De l’extrasystole droite à la TV.
- 10b. De l’ESV gauche à la tachycardie ventriculaire
- 10c. Arythmie ventriculaire, Brugada, QT long
- 10d. Prise en charge d’une tachycardie à complexes QRS larges
Faites des quiz sur le site web (plusieurs niveaux de connaissance 1 à 3)
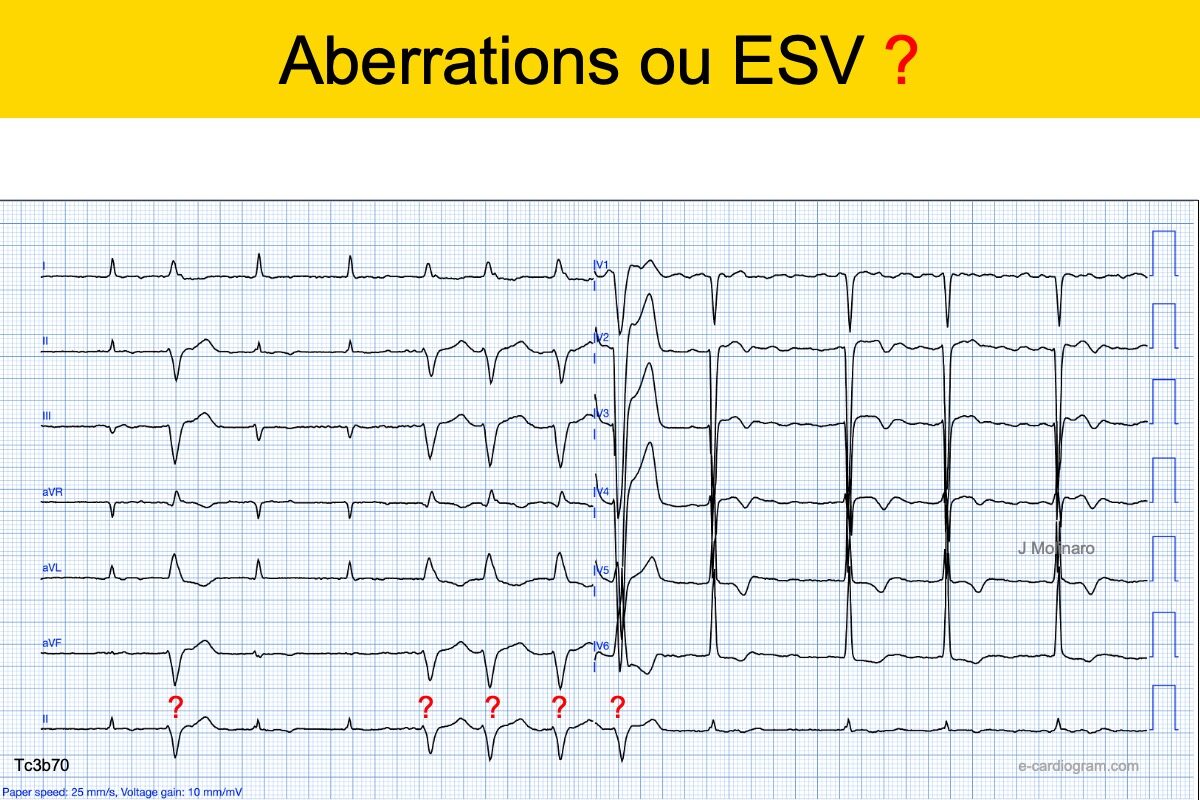
Solution Quiz. Aberration ou ectopie 2
Homme 39 ans. Palpitations soudaines (quiz pas si simple)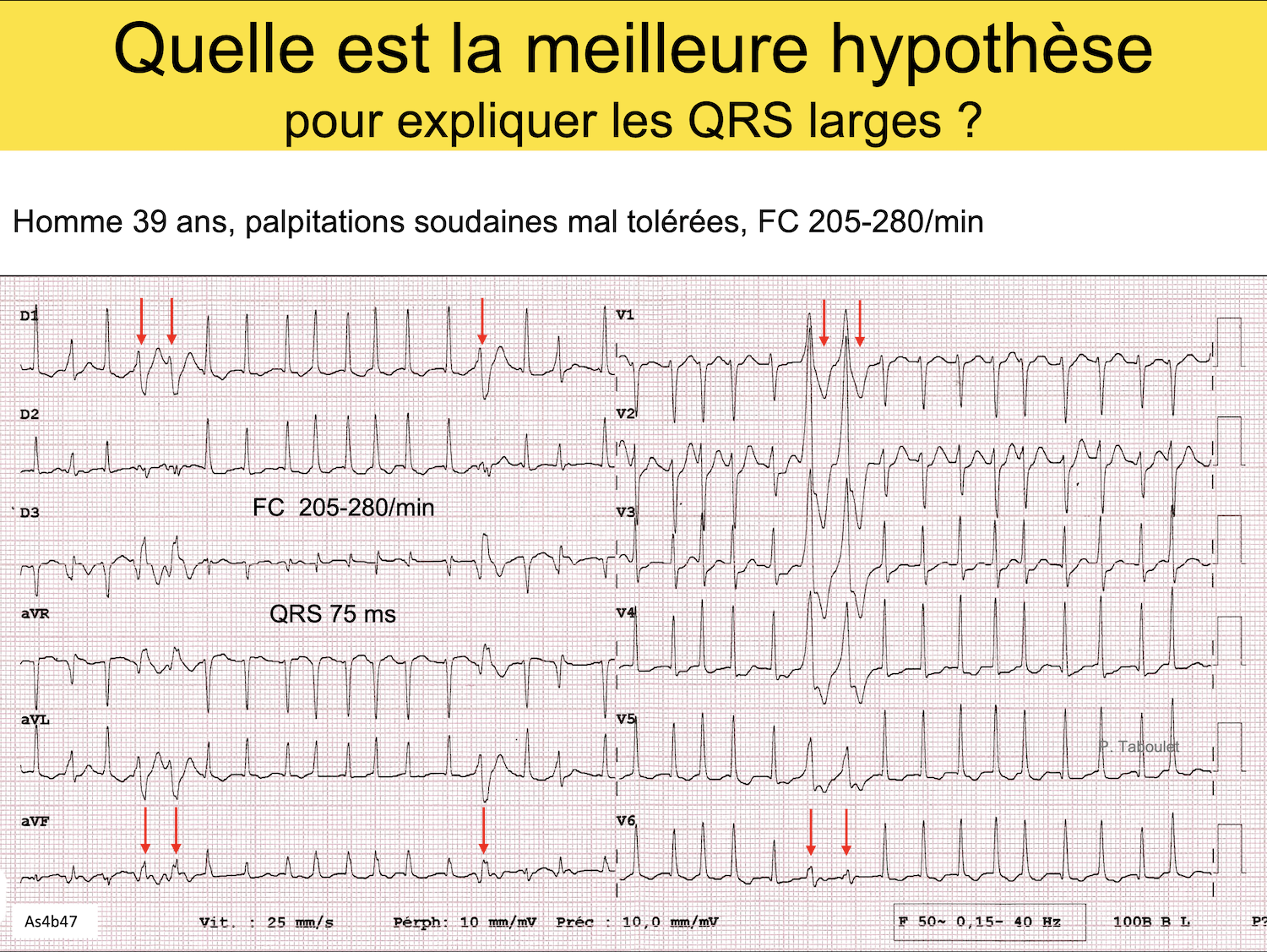
Solution Quiz. Tachycardie à QRS larges 2.
Si vous souhaitez améliorer ce contenu, merci de me contacter
Livre ECG de A à Z et autres (P. Taboulet, 2e ed. 2025)
Faîtes des quiz (site web)
Playlist ECG Minute (hebdomadaire 10 min)
Formations YouTube sur ma playlist (https://www.youtube.com/c/PierreTaboulet-ECG)
Inscrivez-vous à ma newsletter (https://www.e-cardiogram.com/newsletter)
Références et réponses au quiz (réservées aux abonnées)
La suite est réservée aux membres et stagiaires du site.
Se connecter | Devenir membre | Devenir stagiaire